Ela parece uma companheira chata que insiste em não se ausentar. Durante o dia, à noite, no trabalho e até mesmo logo após acordar, marca presença e teima em sugar as nossas energias. Estamos falando da fadiga, aquele cansaço interminável e persistente que dá a sensação de que qualquer atividade cotidiana exige um esforço sobre- humano para ser realizada.
O problema pode ser, sem dúvida, um reflexo da vida moderna. Afinal, passar horas no trânsito todos os dias, trabalhar demais e viver naquele estresse constante acaba levando ao esgotamento do corpo e da mente. Porém, existem outros casos em que a fadiga pode ser consequência de uma noite maldormida ou, mais grave ainda, sintoma de uma doença. "Muitas vezes, os pacientes se queixam de falta de energia. Mas trata-se de uma expressão muito vaga, capaz de indicar desde sonolência até depressão", analisa o neurologista Israel Roitman, especialista em medicina do sono do Hospital Israelita Albert Einstein, na capital paulista.
O fato é que a canseira exacerbada tem origem de fato no cérebro. Ele envia a todo momento impulsos elétricos para o corpo, e esses impulsos, ao chegarem aos músculos, sofrem reações químicas, resultando em energia mecânica — ou seja, nos movimentos. "A fadiga é fruto de um desequilíbrio, ou seja, quando não há harmonia entre esses estímulos", afirma Cláudio Pavanelli, fisiologista do Flamengo, no Rio de Janeiro.
É claro que ninguém está fadado a viver lutando para manter o pique em alta. Algumas mudanças no estilo de vida já ajudam a repor o gás total. Além disso, entender as causas do esgotamento é primordial para domá-lo, principalmente nos casos em que ele vem de enfermidades. Por isso, nada de desanimar: o importante é se mexer e recarregar as baterias.
A síndrome da fadiga crônica Quando o cansaço persiste por meses a fio e não tem causa definida, ele pode ganhar essa alcunha. Apesar de não ter sido completamente desvendada, os pesquisadores acreditam que a síndrome da fadiga crônica decorre de infecções e doenças autoimunes. Para contorná-la, exercícios físicos e hábitos alimentares saudáveis são essenciais.
Por que a pilha fica fraca?
1. Pré-diabetes e Diabetes
Como a principal marca da doença é a dificuldade de o açúcar entrar nas células, seja pela falta de produção de insulina, seja pela incapacidade desse hormônio de trabalhar, a glicose no sangue se eleva. "e a glicemia alta faz o indivíduo urinar mais, emagrecer e perder massa magra. Por isso, é comum diabéticos terem cansaço muscular", afirma Maria Ângela Zaccarelli, euroendocrinologista do Hospital Beneficência Portuguesa, em São Paulo. Além disso pacientes diabéticos frequentemente apresentam deficiência de magnésio, zinco e vitaminas do complexo B, o que por sí só ja determina a fadiga.
2. Anemia
A escassez de ferro não tem como sinal único a pele pálida. a fadiga é uma de suas características predominantes. "a anemia pode causar cansaço, sono, desânimo, queda de cabelos e até mesmo falta de ar", afirma a nutricionista Roseli Ueno, da Universidade de São Paulo. Nas mulheres, é um fenômeno mais recorrente durante a menstruação, quando a perda de sangue aumenta o déficit de ferro no organismo.
3. Apnéia
O popular ronco destrói a qualidade do sono do indivíduo. ele é duas vezes mais frequente nos homens do que nas mulheres e, por se distinguir pela interrupção da passagem do ar pela garganta, provoca o ruído e despertares breves durante a noite. essa insconstância durante o repouso noturno pode ter como consequência uma leseira sem hora para acabar no dia seguinte.
4. Depressão
Vigor abaixo de zero é um traço de quem padece desse problema. apesar de ser uma doença de origem psíquica, a depressão mina a disposição física. "Nela, ocorre um processo inflamatório dentro dos neurônios que atrapalha seu funcionamento. e isso acaba gerando o cansaço", afirma o psiquiatra teng Chei tung, do instituto de Psiquiatria do Hospital das Clínicas de São Paulo.
5. Fibromialgia
Essa síndrome aflora a sensibilidade para a dor. estima-se que apenas um homem a cada oito mulheres apresenta a doença, que tem raiz genética, podendo passar de mãe para filha. as dores constantes levam à debilitação. "a pessoa pode ter o sono perturbado e levantar fatigada, sem falar que a própria dor já gera indisposição", explica o reumatologista Roberto Heymann, da Sociedade Brasileira de Reumatologia.
6. Doença cardíaca
Piripaques no peito também estão na lista dos motivos por trás de uma letargia. arritmia e entupimento de artérias são alguns dos precursores da canseira exacerbada. "o coração problemático não bombeia direito o sangue para todos os órgãos. Com isso, eles tendem a entrar em falência", avisa Ricardo Pavanello, supervisor de cardiologia do Hospital do Coração de São Paulo. Sinal do perigo: uma baita fadiga
7. Distúrbios da tireóide
os hormônios tireoidianos são vitais para manter o metabolismo aceso. Uma característica comum entre o hipertireoidismo, quando a tireoide trabalha demais, e o hipotireoidismo, situação em que a glândula fica lenta, é a apatia total. "o coração bate muito rápido e o indivíduo se queixa de cansaço extremo", afirma Maria Ângela Zaccarelli.
8. Infecções
Além da febre, outro sinal que deve ser notado nesses casos é a diminuição, por assim dizer, da vitalidade. Seja naquela gripe passageira, seja em um quadro mais severo, como a hepatite, a pessoa fica enfraquecida, em maior ou menor grau. "é que o organismo concentra suas forças na luta contra o agente infeccioso", justifica o infectologista Plínio trabasso, da Universidade estadual de Campinas, no interior paulista. daí o esgotamento do indivíduo.
10. Síndrome da Fadiga crônica
Patologia ainda pouco estudada, mas que determinada uma sensação de cansaço sem fim, no qual mesmo após o repouso físico e mental a sensação persiste. Existem várias possíveis etiologias, porém nada 100% estabelecido pela ciência.
11. Deficiência nutricional
Diversas vitaminas, minerais, aminoácidos e ácidos graxos quando em deficiência, podem ocasionar a sensação de cansaço. O nosso solo está cada vez mais desgastado, a reposição correta de tais substâncias não é feita de forma adequada e as pessoas também não ingerem diariamente quantidades suficientes de inúmeros micronutrientes, o que favorece a sensação. Muitas vezes as dosagem sanguíneas de minerais, vitaminas e aminoácidos não corresponde à realidade no tecido, então é comum pacientes apresentarem por exemplo, baixa de magnésio e no exame de sangue o mesmo apresentar-se dentro dos níveis de referência.
6 táticas para recarregar as baterias: Hábitos e atitudes que energizam o dia a dia
1.Checkups
Se a fadiga não vai embora, o importante é procurar auxílio de um médico. ele poderá pedir exames como hemograma, teste de glicemia, dosagem hormonal e outros mais específicos, caso do eletrocardiograma e do teste de função hepática, que ajudam a identificar o que está prejudicando a disposição.
2. Hidratação
Para quem não quer se cansar, um conselho: manter o corpo abastecido de líquidos pode ser uma tática de sucesso. "Se a pessoa não se hidratar, as células vão extrair a água da circulação. o sangue se torna mais denso e a absorção da energia também vai ser dificultada", explica o fisiologista Cláudio Pavanelli.
3. Alimentar-se regularmente
Fazer refeições a cada três horas é outro segredo para afastar a fadiga ao evitar a queda brusca das taxas de açúcar no sangue. "a maioria dos indivíduos que reclamam de falta de energia não come direito", ressalta Roseli Ueno. Proteínas, carboidratos, fibras e gorduras como o ômega-3 devem estar no cardápio.
4. Exercícios físicos
Exercitar o corpo melhora a captação, o transporte e a utilização do oxigênio em nosso organismo. Coração, pulmão e músculos conseguem converter mais desse gás em energia. Por isso, deixar a preguiça de lado e mexer o corpo é um excelente começo para driblar o cansaço constante.
5. Dormir bem
Pregar os olhos por pelo menos oito horas é sinônimo de disposição. o neurologista israel Roitman dá a receita do bom sono: evitar álcool, bebidas cafeinadas e refeições pesadas; ir para a cama sempre no mesmo horário; por fim, nada de ver tv, usar o computador e se exercitar até três horas antes de dormir.
6. Atividades prazerosas
Atenuar o estresse é fundamental para fugir da indisposição. e nada melhor do que fazer aquilo de que se gosta para chacoalhar a rotina. "as atividades prazerosas são estimulantes para o cérebro e para o corpo. enfim, evitam que a gente enferruje", afirma o psiquiatra teng Chei tung.
Fonte: http://saude.abril.com.br/edicoes/0340/medicina/motivos-medicos-fadiga-637065.shtml
Mostrando postagens classificadas por relevância para a consulta magnésio. Ordenar por data Mostrar todas as postagens
Mostrando postagens classificadas por relevância para a consulta magnésio. Ordenar por data Mostrar todas as postagens
sábado, 28 de janeiro de 2012
10 motivos médicos por trás da fadiga
Postado por
Dr. Frederico Lobo
às
21:30
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

quarta-feira, 21 de dezembro de 2011
Aditivos alimentares e seus malefícios
Mas antes de explicar, sugiro que você me siga no instagram: @drfredericolobo para mais informações de qualidade em Nutrologia e Medicina. Lá, posto principalmente nos stories, informação de qualidade e no feed, junto com meus afilhados postamos sobre vários temas.
Como consigo supervisionar as visitas do blog e como chegaram até ele, percebi que um dos textos mais procurados era justamente o de aditivos alimentares. Os internautas digitavam o tema no google e "caiam" no meu blog. Mas o mais interessante é que olhando a origem das buscas, percebi que a maioria dos que procuravam sobre o assunto, são oriundos de Portugal. Vejo que por lá a população está mais consciente que inúmeras patologias, dentre elas alergias, hiperatividade, podem ser ocasionadas ou garavadas por tais aditivos.
Fiz uma busca na internet, a fim de encontrar a tabela com códigos dos corantes. A lista é grande e por fim encontrei a legistação do Brasil. Nosso país tem uma lista pequena de corantes permitidos, porém alguns dos que aqui são permitidos são expressamente proibidos em diversos países. Vejamos..
Como consigo supervisionar as visitas do blog e como chegaram até ele, percebi que um dos textos mais procurados era justamente o de aditivos alimentares. Os internautas digitavam o tema no google e "caiam" no meu blog. Mas o mais interessante é que olhando a origem das buscas, percebi que a maioria dos que procuravam sobre o assunto, são oriundos de Portugal. Vejo que por lá a população está mais consciente que inúmeras patologias, dentre elas alergias, hiperatividade, podem ser ocasionadas ou garavadas por tais aditivos.
Regulação do uso de aditivos alimentares
A segurança no uso de corantes alimentares é testada em diversos órgãos ao redor do mundo e às vezes diferentes órgãos possuem diferentes pontos de vista sobre a segurança destes produtos.
Nos Estados Unidos, são emitidos pela FFDCA (Federal Food, Drug, and Cosmetic Act) números aos corantes alimentares sintéticos aprovados e que não existem naturalmente.
Já na União Européia, a letra E (seguida de um número ), é utilizado para todos os aditivos aprovados para aplicação em alimentos. Nesse sistema de classificação, os corantes compreendem a faixa E100 até E199.
Quase todos os outros países têm suas próprias regulamentações e listas de corantes alimentares que podem ser empregados, incluindo quais os limites máximos diários de ingestão de cada substância.
Quase todos os outros países têm suas próprias regulamentações e listas de corantes alimentares que podem ser empregados, incluindo quais os limites máximos diários de ingestão de cada substância.
No Brasil, 11 são os corantes permitidos:
1) Tartrazina - E102 ou C.I. 19140
É corante amarelo-alaranjado de bebidas, pudins, molhos e doces em geral. Pode provocar: reações alérgicas como asma, bronquite, rinite, náusea, broncoespasmo, urticária, eczema, dor de cabeça, eosinofilia e inibição da agregação plaquetária à semelhança dos salicilatos. Insônia em crianças associada à falta de concentração e impulsividade. Reação alérgica cruzada com salicilatos (ácido acetilsalicílico), hipercinesia em pacientes hiperativos. Pode provocar hiperatividade em crianças quando associado ao benzoato de sódio. No Brasil, nos EUA e na Inglaterra seu uso deve ser indicado nos rótulos.
2) Verde Rápido - E142
3) Amarelo Crepúsculo - E110, Amarelo 6 ou C.I. 15985.
Pode provocar reações anafilactóides, angioedema, choque anafilático, vasculite e púrpura. Reação cruzada com paracetamol, ácido acetilsalicílico, benzoato de sódio (conservante) e outros corantes azóicos como a tartrazina. Pode provocar hiperatividade em crianças quando associado ao benzoato de sódio. Banido na Áustria, Finlândia e Noruega. Devido a questão do possível efeito de desencadeamento de hiperatividade em crianças, o Reino Unido está estudando baní-lo, além dos seguintes: tartrazina (E102), ponceau 4R (E124), azorrubina (E122), vermelho 40 (E129) e o amarelo quinolina (E104).
4) Azul Patente V - E131
Corante azul-violeta usado em confeitaria: produz hiperatividade infantil, crises de asma, reações alérgicas similares à aspirina e outras intolerâncias.
5) Amaranto - E123, Vermelho 2, Vermelho Ácido 27 ou C.I. 16185
Foi banido nos EUA em 76 por suspeitas de ser carcinogênico, mas ainda é utilizado em nosso país.
6) Azorrubina - E122
Corante púrpura-avermelhado usado em bebidas de framboesa e confeitaria: produz as mesmas reações da tartrazina.
7) Ponceau 4R - C.I. 16255 ou Vermelho Cochineal A, C.I. Vermelho Ácido 18, Escarlate Brilhante 4R ou E124.
Corante vermelho usado em produtos à base de morango, balas, pudins e bolos. Está relacionado à anemia e doenças renais, associado à falta de concentração e impulsividade e pode provocar hiperatividade em crianças quando associado ao benzoato de sódio. Banido nos EUA e na Finlândia.
8) Vermelho 40 - Conhecido também como Vermelho Allura, Vermelho Alimentício 17, C.I. 16035 ou E129.
Pode provocar hiperatividade em crianças quando associado ao benzoato de sódio. Banido na Alemanha, Áustria, França, Bélgica, Dinamarca, Suécia e Suíça.
9) Eritrosina - E127, conhecida também pelo nome de Vermelho número 3.
É um corante de cor vermelho-cereja. Suspeito de causar câncer de tireóide em ratos. Banido nos EUA e na Noruega.
10) Azul Indignotina - Também conhecido por Azul número 2 ou E132.
É o mesmo corante conhecido por Indigo Blue (o mesmo do Sr. Baeyer, aquela das calças jeans).
11) Azul Brilhante - Também conhecido pelo nome de Azul número 1, Azul Ácido 9 ou E133.
Ele pode ser combinado com a tartrazina a fim de produzir uma gama variada de verdes, já que a maioria dos corantes verdes artificiais é tóxica para consumo humano. Pode provocar: Irritações cutâneas e constrição brônquica, quando associado a outros corantes. Banido na Alemanha, Áustria, França, Bélgica, Noruega, Suécia e Suíça.
Corantes alimentares naturais
O corante caramelo (E150) é encontrado nos produtos à base de extrato de noz-de-cola. É produto da caramelização do açúcar.
O colorau é um pó laranja-avermelhado extraído da semente do urucuzeiro, uma árvore natural de países da América tropical, como o Brasil.
A chlorella é verde, e deriva das algas.
O carmim é um corante derivado da cochonilha, um inseto popularmente conhecido como pulgão.
O suco de beterraba, a cúrcuma, o açafrão e as plantas do gênero Capsicum são também utilizados como corantes.
O dióxido de titânio (E171), um pó que produz coloração branca nos alimentos, é encontrado naturalmente em minerais.
Problemas de saúde
A Noruega baniu todos os produtos contendo creosoto mineral e derivados em 1978. Uma nova legislação revogou esse banimento em 2001, depois de regulamentação da União Européia. Similarmente, muitos corantes aprovados pela FFDCA foram banidos da UE.
Guia do Consumidor
Os aditivos se dividem da seguinte maneira:
Códigos das CLASSES dos corantes (INS - Sistema internacional de Numeração)
Corantes naturais C.I (Corante de Urucum, Carmin de Cochonilha, Corante de Cúrcuma, Corante de Clorofila, Corante de Páprica, Corante de Beterraba, Corantes de Antocianina)
Corantes artificiais C.II
Corantes sintéticos idênticos aos naturais C.III
Corantes inorgânicos C.IV
Corantes caramelo C.IV
Código dos corantes de 100-199
100-109 – amarelos
110-119 – laranjas
120-129 – vermelhos
130-139 – azuis e violetas
140-149 – verdes
150-159 – castanhos e pretos
160-199 – outras
Código dos Conservantes de 200-299
200-209 – sorbatos
210-219 – benzoatos
220-229 – sulfitos
230-239 – fenóis e formatos (metanoatos)
240-259 – nitratos
260-269 – acetatos (etanoatos)
270-279 – lactatos
280-289 – propionatos (propanoatos)
290-299 – outros
Código de Antioxidantes e Reguladores de acidez de 300-399
300-309 – ascorbatos (vitamina C)
310-319 – galatos e eritorbatos
320-329 – lactatos
330-339 – citratos e tartaratos
340-349 – fosfatos
350-359 – malatos e adipatos
360-369 – succinatos e fumaratos
370-399 – outros
Código de Espessantes, estabilizadores gelificantes e emulsionantes de 400-499
400-409 – alginatos
410-419 – gomas naturais
420-429 – outros agentes naturais
430-439 – compostos de polioxietileno
440-449 – emulsionantes naturais
450-459 – fosfatos
460-469 – compostos de celulose
470-489 – compostos de ácidos gordoss e seus compostos
490-499 – outros
Código de Reguladores de pH e antiaglomerantes de 500-599
500-509 – ácidos e bases minerais
510-519 – cloretos e sulfatos
520-529 – sulfatos e hidróxidos
530-549 – compostos de metais alcalinos
550-559 – silicatos
570-579 – estearatos e gluconatos
580-599 – outros
Código de Intensificadores de sabor de 600-699
620-629 – glutamatos
630-639 – inosinatos
640-649 – outros
Código de vários outros aditivos de 900-999
900-909 – ceras
910-919 – agentes de revestimento e brilho sintéticos
920-929 – melhorantes
930-949 – gases de embalagem
950-969 – Edulcorantes
990-999 – Agentes de espuma
Químicos adicionais de 1100-1599.
São os produtos químicos recentes que não se encaixam no sistema de classificação existente
GUIA DE CÓDIGOS pelo SISTEMA E
Corantes
E100 Curcumina
E101 Riboflavina (OGM?)
E101a Riboflavina-5'-fosfato (OGM?)
E102 Tartrazina (PRA)
E104 Amarelo quinoleína (PRA)
E110 Amarelo sol FCF (PRA)
E120 Cochonilha, Ácido carmínico e carminas (PRA) (OA)
E122 Carmosina, Azorubina (PRA)
E123 Amaranto (PRA)
E124 Ponceau 4R, Vermelho cochonilha A (PRA)
E127 Eritrosina (PRA)
E128 Vermelho 2G (PRA)
E129 Vermelho AC (PRA)
E131 Azul patenteado V (PRA)
E132 Indigotina (PRA)
E133 Azul brilhante FCF (PRA)
E140 Clorofilas e clorofilinas
E141 Complexos cúpricos de clorofila
E142 Verde S (PRA)
E150a Caramelo
E150b Caramelo sulfítico cáustico (OGM?)
E150c Caramelo de amónia (OGM?)
E150d Caramelo sulfítico de amónia (OGM?)
E151 Negro PN, Negro brilhante (PRA)
E153 Carvão vegetal (OGM?) (OA ?)
E154 Castanho FK (PRA)
E155 Castanho HT (PRA)
E160a α-Caroteno, β-caroteno, γ-caroteno
E160b Anato, bixina, norbixina (PRA)
E160c Extracto de pimentão, capsantina e capsorubina
E160d Licopeno (OGM?)
E160e β-apo-8'-carotenal (C 30)
E160f Éster etílico de ácido β-apo-8'-caroténico (C 30)
E161b Luteína
E161g Cantaxantina (OA?)
E162 Vermelho de beterraba
E163 Antocianina
E170 Carbonato de cálcio, calcário
E171 Dióxido de titânio
E172 Óxidos e hidróxidos de ferro
E173 Alumínio
E174 Prata
E175 Ouro
E180 Litolrubina BK
Conservantes
E200 Ácido sórbico
E202 Sorbato de potássio
E203 Sorbato de cálcio
E210 Ácido benzóico (PRA)
E211 Benzoato de sódio (PRA)
E212 Benzoato de potássio (PRA)
E213 Benzoato de cálcio (PRA)
E214 p-hidroxibenzoato de etilo (PRA)
E215 Sal de sódio de p-hidroxibenzoato de etilo (PRA)
E216 p-hidroxibenzoato de propilo (PRA)
E217 Sal de sódio de p-hidroxibenzoato de propilo (PRA)
E218 p-hidroxibenzoato de metilo (PRA)
E219 Sal de sódio de p-hidroxibenzoato de metilo (PRA)
E220 Dióxido de enxofre (PRA)
E221 Sulfito de sódio (PRA)
E222 Bissulfito de sódio (PRA)
E223 Metabissulfito de sódio (PRA)
E224 Metabissulfito de potássio (PRA)
E226 Sulfito de cálcio (PRA)
E227 Bissulfito de cálcio (PRA)
E228 Bissulfito de potássio (PRA)
E230 Bifenilo, difenilo
E231 Ortofenilfenol
E232 Ortofenilfenato de sódio
E234 Nisina
E235 Natamicina, Pimaracina
E239 Hexametilenotetramina
E242 Dicarbonato dimetílico
E249 Nitrito de potássio
E250 Nitrito de sódio
E251 Nitrato de sódio
E252 Nitrato de potássio (OA?)
E260 Ácido acético
E261 Acetato de potássio
E262 Acetato de sódio
E263 Acetato de cálcio
E280 Ácido propiónico
E281 Propionato de sódio
E282 Propionato de cálcio (PRA)
E283 Propionato de potássio
E284 Ácido bórico
E285 Tetraborato de sódio ou Borax
E296 Ácido málico
E1105 Lisozima
Antioxidantes
E300 Ácido ascórbico (Vitamina C)
E301 Ascorbato de sódio
E302 Ascorbato de cálcio
E304 Ésteres de ácidos gordos do ácido ascórbico a) palmitato de ascorbilo e b) estearato de ascorbilo
E306 Extractos naturais ricos em tocoferóis (OGM?)
E307 α-tocoferol (sintético) (OGM?)
E308 γ-tocoferol (sintético) (OGM?)
E309 δ-tocoferol (sintético) (OGM?)
E310 Galato de propilo (PRA)
E311 Galato de octilo (PRA)
E312 Galato de dodecilo (PRA)
E315 Ácido eritórbico
E316 Eritorbato de sódio
E320 Butil-hidroxianisolo ou (BHA)
E321 Butil-hidroxitolueno ou (BHT) (PRA)
Emulsionantes, estabilizadores, espessantes e gelificantes
E322 Lecitinas (emulsionante)
E330 Ácido cítrico
E400 Ácido algínico (espessante, emulsionante, estabilizador, gelificante)
E401 Alginato de sódio (espessante, emulsionante, estabilizador, gelificante)
E402 Alginato de potássio (espessante, emulsionante, estabilizador, gelificante)
E403 Alginato de amónio (espessante, emulsionante, estabilizador)
E404 Alginato de cálcio (espessante, emulsionante, estabilizador, gelificante)
E405 Alginato de propilenoglicol) (espessante, emulsionante, estabilizador)
E406 Ágar-ágar (espessante, estabilizador, gelificante)
E407 Carragenina (espessante, emulsionante, estabilizador, gelificante) (PRA)
E407a Algas Eucheuma transformadas (espessante, emulsionante, estabilizador, gelificante)
E410 Farinha de semente de alfarroba (espessante, emulsionante, estabilizador, gelificante)
E412 Goma de guar (espessante, estabilizador)
E413 Goma adragante (espessante) (estabilizador, emulsionante) (PRA)
E414 Goma arábica (espessante) (estabilizador, emulsionante) (PRA)
E415 Goma xantana (espessante) (estabilizador) (OGM?)
E416 Goma karaya (espessante) (estabilizador, emulsionante) (PRA)
E417 Goma de tara (espessante) (estabilizador)
E418 Goma gelana (espessante) (estabilizador, emulsionante)
E432 Polissorbato 20 (emulsionante) (OA?)
E433 Polissorbato 80 (emulsionante) (OA?)
E434 Polissorbato 40 (emulsionante) (OA?)
E435 Polissorbato 60 (emulsionante) (OA?)
E436 Polissorbato 65 (emulsionante) (OA?)
E440 Pectina e pectina amidada (emulsionante)
E442 Fosfatidato de amónio
E444 Ésteres acético e isobutírico da sacarose (emulsionante)
E445 Ésteres de glicerol da colofónia (emulsionante)
E450 Difosfatos: (i) Difosfato dissódico (ii) Difosfato trissódico (iii) Difosfato tetrassódico (iv) Difosfato dipotássico (v) Difosfato tetrapotássico (vi) Difosfato dicálcico (vii) Hidrogenodifosfato de cálcio (emulsionante)
E451 Trifosfatos: (i) Trifosfato pentassódico (ii) Trifosfato pentapotássico (emulsionante)
E452 Polifosfatos: (i) Polifosfatos de sódio (ii) Polifosfatos de potássio (iii) Polifosfatos de sódio e cálcio (iv) Polifosfatos de cálcio (emulsionante)
E460 Celulose (i) Celulose microcristallina (ii) celulose em pó (emulsionante)
E461 Metilcelulose (emulsionante)
E463 Hidroxipropilcelulose (emulsionante)
E464 Hidroxipropil-metilcelulose (emulsionante)
E465 Etilmetilcelulose (emulsionante)
E466 Carboximetilcelulose, carboximetilcelulose sódica (emulsionante)
E468 Carboximetilcelulose sódica reticulada (emulsionante)
E469 Carboximetilcelulose hidrolisada enzimaticamente (emulsionante)
E470a Sais de cálcio, potássio e sódio de ácidos gordos (emulsionante, anti-aglomerante) (OA?)
E470b Sais de magnésio de ácidos gordos (emulsionante, anti-aglomerante) (OA?)
E471 Mono e diglicéridos de ácidos gordos (emulsionante) (OGM?) (OA?)
E472a Ésteres acéticos de mono e diglicéridos de ácidos gordos (emulsionante) (OGM?) (OA?)
E472b Ésteres lácticos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472c Ésteres cítricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472d Ésteres tartáricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472e Ésteres monoacetiltartáricos e diacetiltartáricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472f Ésteres mistos acéticos e tartáricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E473 Ésteres de sacarose de ácidos gordos (emulsionante) (OGM?) (OA?)
E474 Sacaridoglicéridos (emulsionante) (OA?)
E475 Ésteres de poliglicerol de ácidos gordos (emulsionante) (OGM?) (OA?)
E476 Polirricinoleato de poliglicerol (emulsionante) (OGM?) (OA?)
E477 Ésteres de propilenoglicol de ácidos gordos (emulsionante) (OGM?) (OA?)
E481 Estearilo-2-lactilato de sódio (emulsionante) (OA?)
E482 Estearilo-2-lactilato de cálcio (emulsionante) (OA?)
E483 Tartarato de estearilo (emulsionante) (OA?)
E491 Monoestearato de sorbitano (emulsionante) (OGM?) (OA?)
E492 Triestearato de sorbitano (emulsionante) (OA?)
E493 Monolaurato de sorbitano (emulsionante) (OA?)
E494 Mono-oleato de sorbitano (emulsionante) (OA?)
E495 Monopalmitato de sorbitano (emulsionante) (OA?)
E620 glutamatos.
E640 glutamatos.
E1103 Invertase
Edulcorantes (adoçantes)
E420 Sorbitol
E421 Manitol
E950 Acesulfame-K
E951 Aspartame
E952 Ácido ciclâmico e seus sais de sódio e cálcio
E953 Isomalte
E954 Sacarina e seus sais de sódio, potássio e cálcio
E957 Taumatina
E959 Neo-hesperidina di-hidrochalcona
E965 Maltitol
E966 Lactitol (OA)
E967 Xilitol
E999 Extracto de quilaia
Para os que quiserem ler mais sobre o assunto:
ANVISA
http://www.anvisa.gov.br/ALIMENTOS/legis/especifica/aditivos.htm
Tabela de aditivos alimentares
http://www.anvisa.gov.br/alimentos/aditivos_farmaco.htm
Aditivos UFRJ
http://aditivosquimicos-ufrj.blogspot.com/2008/07/corantes.html
Autor: Dr. Frederico Lobo - Médico Nutrólogo
O corante caramelo (E150) é encontrado nos produtos à base de extrato de noz-de-cola. É produto da caramelização do açúcar.
O colorau é um pó laranja-avermelhado extraído da semente do urucuzeiro, uma árvore natural de países da América tropical, como o Brasil.
A chlorella é verde, e deriva das algas.
O carmim é um corante derivado da cochonilha, um inseto popularmente conhecido como pulgão.
O suco de beterraba, a cúrcuma, o açafrão e as plantas do gênero Capsicum são também utilizados como corantes.
O dióxido de titânio (E171), um pó que produz coloração branca nos alimentos, é encontrado naturalmente em minerais.
Problemas de saúde
A Noruega baniu todos os produtos contendo creosoto mineral e derivados em 1978. Uma nova legislação revogou esse banimento em 2001, depois de regulamentação da União Européia. Similarmente, muitos corantes aprovados pela FFDCA foram banidos da UE.
Guia do Consumidor
Os aditivos se dividem da seguinte maneira:
Códigos das CLASSES dos corantes (INS - Sistema internacional de Numeração)
Corantes naturais C.I (Corante de Urucum, Carmin de Cochonilha, Corante de Cúrcuma, Corante de Clorofila, Corante de Páprica, Corante de Beterraba, Corantes de Antocianina)
Corantes artificiais C.II
Corantes sintéticos idênticos aos naturais C.III
Corantes inorgânicos C.IV
Corantes caramelo C.IV
Código dos corantes de 100-199
100-109 – amarelos
110-119 – laranjas
120-129 – vermelhos
130-139 – azuis e violetas
140-149 – verdes
150-159 – castanhos e pretos
160-199 – outras
Código dos Conservantes de 200-299
200-209 – sorbatos
210-219 – benzoatos
220-229 – sulfitos
230-239 – fenóis e formatos (metanoatos)
240-259 – nitratos
260-269 – acetatos (etanoatos)
270-279 – lactatos
280-289 – propionatos (propanoatos)
290-299 – outros
Código de Antioxidantes e Reguladores de acidez de 300-399
300-309 – ascorbatos (vitamina C)
310-319 – galatos e eritorbatos
320-329 – lactatos
330-339 – citratos e tartaratos
340-349 – fosfatos
350-359 – malatos e adipatos
360-369 – succinatos e fumaratos
370-399 – outros
Código de Espessantes, estabilizadores gelificantes e emulsionantes de 400-499
400-409 – alginatos
410-419 – gomas naturais
420-429 – outros agentes naturais
430-439 – compostos de polioxietileno
440-449 – emulsionantes naturais
450-459 – fosfatos
460-469 – compostos de celulose
470-489 – compostos de ácidos gordoss e seus compostos
490-499 – outros
Código de Reguladores de pH e antiaglomerantes de 500-599
500-509 – ácidos e bases minerais
510-519 – cloretos e sulfatos
520-529 – sulfatos e hidróxidos
530-549 – compostos de metais alcalinos
550-559 – silicatos
570-579 – estearatos e gluconatos
580-599 – outros
Código de Intensificadores de sabor de 600-699
620-629 – glutamatos
630-639 – inosinatos
640-649 – outros
Código de vários outros aditivos de 900-999
900-909 – ceras
910-919 – agentes de revestimento e brilho sintéticos
920-929 – melhorantes
930-949 – gases de embalagem
950-969 – Edulcorantes
990-999 – Agentes de espuma
Químicos adicionais de 1100-1599.
São os produtos químicos recentes que não se encaixam no sistema de classificação existente
GUIA DE CÓDIGOS pelo SISTEMA E
Corantes
E100 Curcumina
E101 Riboflavina (OGM?)
E101a Riboflavina-5'-fosfato (OGM?)
E102 Tartrazina (PRA)
E104 Amarelo quinoleína (PRA)
E110 Amarelo sol FCF (PRA)
E120 Cochonilha, Ácido carmínico e carminas (PRA) (OA)
E122 Carmosina, Azorubina (PRA)
E123 Amaranto (PRA)
E124 Ponceau 4R, Vermelho cochonilha A (PRA)
E127 Eritrosina (PRA)
E128 Vermelho 2G (PRA)
E129 Vermelho AC (PRA)
E131 Azul patenteado V (PRA)
E132 Indigotina (PRA)
E133 Azul brilhante FCF (PRA)
E140 Clorofilas e clorofilinas
E141 Complexos cúpricos de clorofila
E142 Verde S (PRA)
E150a Caramelo
E150b Caramelo sulfítico cáustico (OGM?)
E150c Caramelo de amónia (OGM?)
E150d Caramelo sulfítico de amónia (OGM?)
E151 Negro PN, Negro brilhante (PRA)
E153 Carvão vegetal (OGM?) (OA ?)
E154 Castanho FK (PRA)
E155 Castanho HT (PRA)
E160a α-Caroteno, β-caroteno, γ-caroteno
E160b Anato, bixina, norbixina (PRA)
E160c Extracto de pimentão, capsantina e capsorubina
E160d Licopeno (OGM?)
E160e β-apo-8'-carotenal (C 30)
E160f Éster etílico de ácido β-apo-8'-caroténico (C 30)
E161b Luteína
E161g Cantaxantina (OA?)
E162 Vermelho de beterraba
E163 Antocianina
E170 Carbonato de cálcio, calcário
E171 Dióxido de titânio
E172 Óxidos e hidróxidos de ferro
E173 Alumínio
E174 Prata
E175 Ouro
E180 Litolrubina BK
Conservantes
E200 Ácido sórbico
E202 Sorbato de potássio
E203 Sorbato de cálcio
E210 Ácido benzóico (PRA)
E211 Benzoato de sódio (PRA)
E212 Benzoato de potássio (PRA)
E213 Benzoato de cálcio (PRA)
E214 p-hidroxibenzoato de etilo (PRA)
E215 Sal de sódio de p-hidroxibenzoato de etilo (PRA)
E216 p-hidroxibenzoato de propilo (PRA)
E217 Sal de sódio de p-hidroxibenzoato de propilo (PRA)
E218 p-hidroxibenzoato de metilo (PRA)
E219 Sal de sódio de p-hidroxibenzoato de metilo (PRA)
E220 Dióxido de enxofre (PRA)
E221 Sulfito de sódio (PRA)
E222 Bissulfito de sódio (PRA)
E223 Metabissulfito de sódio (PRA)
E224 Metabissulfito de potássio (PRA)
E226 Sulfito de cálcio (PRA)
E227 Bissulfito de cálcio (PRA)
E228 Bissulfito de potássio (PRA)
E230 Bifenilo, difenilo
E231 Ortofenilfenol
E232 Ortofenilfenato de sódio
E234 Nisina
E235 Natamicina, Pimaracina
E239 Hexametilenotetramina
E242 Dicarbonato dimetílico
E249 Nitrito de potássio
E250 Nitrito de sódio
E251 Nitrato de sódio
E252 Nitrato de potássio (OA?)
E260 Ácido acético
E261 Acetato de potássio
E262 Acetato de sódio
E263 Acetato de cálcio
E280 Ácido propiónico
E281 Propionato de sódio
E282 Propionato de cálcio (PRA)
E283 Propionato de potássio
E284 Ácido bórico
E285 Tetraborato de sódio ou Borax
E296 Ácido málico
E1105 Lisozima
Antioxidantes
E300 Ácido ascórbico (Vitamina C)
E301 Ascorbato de sódio
E302 Ascorbato de cálcio
E304 Ésteres de ácidos gordos do ácido ascórbico a) palmitato de ascorbilo e b) estearato de ascorbilo
E306 Extractos naturais ricos em tocoferóis (OGM?)
E307 α-tocoferol (sintético) (OGM?)
E308 γ-tocoferol (sintético) (OGM?)
E309 δ-tocoferol (sintético) (OGM?)
E310 Galato de propilo (PRA)
E311 Galato de octilo (PRA)
E312 Galato de dodecilo (PRA)
E315 Ácido eritórbico
E316 Eritorbato de sódio
E320 Butil-hidroxianisolo ou (BHA)
E321 Butil-hidroxitolueno ou (BHT) (PRA)
Emulsionantes, estabilizadores, espessantes e gelificantes
E322 Lecitinas (emulsionante)
E330 Ácido cítrico
E400 Ácido algínico (espessante, emulsionante, estabilizador, gelificante)
E401 Alginato de sódio (espessante, emulsionante, estabilizador, gelificante)
E402 Alginato de potássio (espessante, emulsionante, estabilizador, gelificante)
E403 Alginato de amónio (espessante, emulsionante, estabilizador)
E404 Alginato de cálcio (espessante, emulsionante, estabilizador, gelificante)
E405 Alginato de propilenoglicol) (espessante, emulsionante, estabilizador)
E406 Ágar-ágar (espessante, estabilizador, gelificante)
E407 Carragenina (espessante, emulsionante, estabilizador, gelificante) (PRA)
E407a Algas Eucheuma transformadas (espessante, emulsionante, estabilizador, gelificante)
E410 Farinha de semente de alfarroba (espessante, emulsionante, estabilizador, gelificante)
E412 Goma de guar (espessante, estabilizador)
E413 Goma adragante (espessante) (estabilizador, emulsionante) (PRA)
E414 Goma arábica (espessante) (estabilizador, emulsionante) (PRA)
E415 Goma xantana (espessante) (estabilizador) (OGM?)
E416 Goma karaya (espessante) (estabilizador, emulsionante) (PRA)
E417 Goma de tara (espessante) (estabilizador)
E418 Goma gelana (espessante) (estabilizador, emulsionante)
E432 Polissorbato 20 (emulsionante) (OA?)
E433 Polissorbato 80 (emulsionante) (OA?)
E434 Polissorbato 40 (emulsionante) (OA?)
E435 Polissorbato 60 (emulsionante) (OA?)
E436 Polissorbato 65 (emulsionante) (OA?)
E440 Pectina e pectina amidada (emulsionante)
E442 Fosfatidato de amónio
E444 Ésteres acético e isobutírico da sacarose (emulsionante)
E445 Ésteres de glicerol da colofónia (emulsionante)
E450 Difosfatos: (i) Difosfato dissódico (ii) Difosfato trissódico (iii) Difosfato tetrassódico (iv) Difosfato dipotássico (v) Difosfato tetrapotássico (vi) Difosfato dicálcico (vii) Hidrogenodifosfato de cálcio (emulsionante)
E451 Trifosfatos: (i) Trifosfato pentassódico (ii) Trifosfato pentapotássico (emulsionante)
E452 Polifosfatos: (i) Polifosfatos de sódio (ii) Polifosfatos de potássio (iii) Polifosfatos de sódio e cálcio (iv) Polifosfatos de cálcio (emulsionante)
E460 Celulose (i) Celulose microcristallina (ii) celulose em pó (emulsionante)
E461 Metilcelulose (emulsionante)
E463 Hidroxipropilcelulose (emulsionante)
E464 Hidroxipropil-metilcelulose (emulsionante)
E465 Etilmetilcelulose (emulsionante)
E466 Carboximetilcelulose, carboximetilcelulose sódica (emulsionante)
E468 Carboximetilcelulose sódica reticulada (emulsionante)
E469 Carboximetilcelulose hidrolisada enzimaticamente (emulsionante)
E470a Sais de cálcio, potássio e sódio de ácidos gordos (emulsionante, anti-aglomerante) (OA?)
E470b Sais de magnésio de ácidos gordos (emulsionante, anti-aglomerante) (OA?)
E471 Mono e diglicéridos de ácidos gordos (emulsionante) (OGM?) (OA?)
E472a Ésteres acéticos de mono e diglicéridos de ácidos gordos (emulsionante) (OGM?) (OA?)
E472b Ésteres lácticos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472c Ésteres cítricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472d Ésteres tartáricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472e Ésteres monoacetiltartáricos e diacetiltartáricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E472f Ésteres mistos acéticos e tartáricos de mono e diglicéridos de ácidos gordos (emulsionante) (OA?)
E473 Ésteres de sacarose de ácidos gordos (emulsionante) (OGM?) (OA?)
E474 Sacaridoglicéridos (emulsionante) (OA?)
E475 Ésteres de poliglicerol de ácidos gordos (emulsionante) (OGM?) (OA?)
E476 Polirricinoleato de poliglicerol (emulsionante) (OGM?) (OA?)
E477 Ésteres de propilenoglicol de ácidos gordos (emulsionante) (OGM?) (OA?)
E481 Estearilo-2-lactilato de sódio (emulsionante) (OA?)
E482 Estearilo-2-lactilato de cálcio (emulsionante) (OA?)
E483 Tartarato de estearilo (emulsionante) (OA?)
E491 Monoestearato de sorbitano (emulsionante) (OGM?) (OA?)
E492 Triestearato de sorbitano (emulsionante) (OA?)
E493 Monolaurato de sorbitano (emulsionante) (OA?)
E494 Mono-oleato de sorbitano (emulsionante) (OA?)
E495 Monopalmitato de sorbitano (emulsionante) (OA?)
E620 glutamatos.
E640 glutamatos.
E1103 Invertase
Edulcorantes (adoçantes)
E420 Sorbitol
E421 Manitol
E950 Acesulfame-K
E951 Aspartame
E952 Ácido ciclâmico e seus sais de sódio e cálcio
E953 Isomalte
E954 Sacarina e seus sais de sódio, potássio e cálcio
E957 Taumatina
E959 Neo-hesperidina di-hidrochalcona
E965 Maltitol
E966 Lactitol (OA)
E967 Xilitol
E999 Extracto de quilaia
Para os que quiserem ler mais sobre o assunto:
ANVISA
http://www.anvisa.gov.br/ALIMENTOS/legis/especifica/aditivos.htm
Tabela de aditivos alimentares
http://www.anvisa.gov.br/alimentos/aditivos_farmaco.htm
Aditivos UFRJ
http://aditivosquimicos-ufrj.blogspot.com/2008/07/corantes.html
Autor: Dr. Frederico Lobo - Médico Nutrólogo
CRM-GO 13192 - RQE 11915
CRM-SC 32949 - RQE 22416
www.nutrologogoiania.com.br
www.nutrologojoinville.com.br
Instagram: @drfredericolobo
Postado por
Dr. Frederico Lobo
às
21:18
12
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

Marcadores:
Bradesco,
corantes,
imas,
ipasgo,
Médico Nutrólogo,
Nutrologo Goiania,
Nutrologo Joinville,
unimed
terça-feira, 31 de maio de 2011
VII Semana Nacional dos Alimentos Orgânicos - Por que vale a pena priorizar os Orgânicos ?
Do dia 30 de Maio a 5 de Junho comemora-se a 7ª Semana Nacional dos Alimentos Orgânicos. Nada mais justo que um post evidenciando os benefícios do uso de orgânicos. Para falar de orgânicos é inevitável que não se cite um assunto de saúde pública: Uso de Agrotóxicos.
Os agrotóxicos são usados no mundo desde a Década de 30, como por exemplo o DDT (sigla de Dicloro-Difenil-Tricloroetano), um inseticida barato e altamente eficaz a curto prazo. A longo prazo tem efeitos prejudiciais à saúde humana, pois permanece no ambiente por décadas. Foi banido de vários países por ser cancerígeno e atingir o sistema nervoso central e periférico como todos organoclorados.
Os organofosforados e carbamatos são uma classe de agrotóxicos bastante usada atualmente. Há estudos inconclusivos que mostram correlação com alterações musculares, efeito neurotóxico e ação disruptora endócrina (pode se ligar a receptores de hormônios e mimetizar a ação destes). Mensalmente são publicados artigos que evidenciam possíveis efeitos dos agrotóxicos para a saúde de seres vivos.
Penso da seguinte maneira: se há risco potencial, porquê consumir um alimento cultivado com agrotóxicos, se temos a opção orgânica ?
Orgânicos são alimentos plantados naturalmente sem o uso de nenhum pesticida como inseticidas, bactericidas, herbicidas, nematicidas, acaricidas, fungicidas de natureza física, química ou biológica. Resumindo: Orgânicos são produtos cultivados sem a adição de Agrotóxicos (ou como alguns chamam, Defensivos Agrícolas).
A produção de orgânicos sempre que possível, baseia-se:
1) No uso de estercos animais, 2) Rotação de culturas, 3) Adubação verde, 4) Compostagem e 5) Controle biológico de pragas e doenças.
Tem como principal objetivo a manutenção da estrutura do solo além da sua produtividade, gerando alimentos saudáveis e produzidos baseados em uma relação harmônica com a natureza (homem/natureza, homem/animais homem/homem). Por esses motivos, eu como médico e ecologista defendo essa causa. Alguns aspectos que sempre ressalto para quem me pergunta "Dr. porque vc está nessa de defender ecologia associada à medicina?":
1) Aspectos sanitários: alimentos orgânicos não possuem "defensivos" agrícolas sintéticos ou qualquer tipo de venenos que possa comprometer a saúde de qualquer ser na escala evolutiva, seja ele um invertebrado, seja ele um homo sapiens. Princípio este que jurei na minha formatura. Princípio este criado pelo pai da Medicina (Hipócrates) "primum non nocere" que significa em primeiro lugar não lesar.
2) Aspectos ecológicos: a agricultura orgânica por não utilizar métodos agressivos e nocivos para a natureza, evita a degradação do meio ambiente. Isso inclui: manutenção das características do solo (as vezes adubando através de rochagem, mas sem utilizar fertilizantes sintéticos), manutenção da potabilidade da água e pureza do ar. A agricultura orgânica geralmente é familiar e ocorre de forma sustentável, na qual se respeita ciclos milenares (plantio/colheita). Desenvolvimento e preservação ambiental andam de forma conjunta.
De formal geral, a agricultura orgânica é baseada em três idéias. São elas:
1) Cultivo natural: é proibido o uso de agrotóxicos, adubos químicos e artificiais e conservantes no processo de produção.
2) Equilíbrio ecológico: A produção respeita o equilíbrio microbiológico do solo e as diferentes épocas de safra. O processo fica mais sustentável, não degradando a biodiversidade.
3) Respeito ao homem: o trabalhador tem que ser respeitado (leis trabalhistas, ganho por produtividade, treinamento profissional e qualidade de vida).
Para se obter um alimento verdadeiramente orgânico, é necessário conhecer diversas ciências (agronomia, ecologia, nutrição, medicina, economia, entre outras). Assim, o agricultor, através de um trabalho harmonizado com a natureza, tem condições de oferecer ao consumidor alimentos que promovam não apenas a saúde deste último, mas também do planeta em que vivemos.
Será que é orgânico mesmo? Como saber?
Se você pretende consumir alimentos orgânicos fique atento para não ser enganado. Procure sempre pelo selo de qualidade emitido por certificadoras reconhecidas pelo Ministério da Agricultura. Para ganhar o selo, os produtores seguem várias precauções e têm suas lavouras fiscalizadas a cada semestre. A presença do selo garante, portanto, a procedência e a qualidade dos produtos.
Existem 10 principais motivos para se optar por orgânicos, são eles:
1) São mais nutritivos e saborosos: Com solos balanceados e fertilizados com adubos naturais, se obtém alimentos mais nutritivos. A comida fica mais saborosa, conservam-se suas propriedades naturais como vitaminas, sais minerais, carboidratos e proteínas. Em solos equilibrados as plantas crescem mais saudáveis, preservam-se suas características originais como aroma, cor e sabor. Consumindo produtos orgânicos é possível apreciar o sabor natural dos alimentos. Além disso, quando se utiliza o sistema de Rochagem na adubagem o alimento fica mais rico devido a inserção de minerais ESSENCIAIS na composição do solo. Algumas pesquisas internacionais (há pesquisas que dizem o contrário) demonstram que alimentos orgânicos apresentam, em média:
2) Sáude garantida: Como citei, agrotóxicos estão associados a diversas patologias, dentre elas:
1) Cânceres dos mais viversos tipos; 2) Alergias alimentares; 3) Asma; 4) Infertilidade; 5) Alterações hormonais principalmente quando se trata de hormônios sexuais; 6) Hiperatividade em adultos e crianças; 7) Déficit de atenção; 8) Doenças neurodegenerativas; 9) Aumento da produção de radicais livres e diminuição da produção de antioxidantes; 10) Intoxicação por metais pesados Um relatório da Academia Americana de Ciências, de 1982, calculou em 1.400.000 o número de novos casos de câncer provocados por agrotóxicos. Vale a pena ler um post que publiquei no meu blog sobre a recente pesquisa da Anvisa, na qual a mesma detectou irregularidade em 29% dos alimentos analisados. Veja também esse post sobre a Reavaliação de agrotóxicos e veja o quão grave é a situação.
3) Proteção às futuras gerações: As crianças são os alvos mais vulneráveis da agricultura com agrotóxicos. “Quando uma criança completa um ano de idade, já recebeu a dose máxima aceitável para uma vida inteira, de agrotóxicos que provocam câncer”, diz um relatório recente do Environmental Working Group (Grupo de Trabalho Ambiental). A agricultura orgânica, além disso mais, tem a grande tarefa de legar às futuras gerações um planeta reconstruído.
4) Respeito ao pequeno produtor: O trabalhador rural precisa ser preservado, tanto quanto a qualidade ecológica dos alimentos. Adquirindo produtos ecológicos, contribuímos com a redução da migração de famílias para as cidades, evitando o êxodo rural e ajudando a acabar com o envenenamento por agrotóxicos sofrido por cerca de 1 milhão de agricultores no mundo inteiro.
5) Solos mais férteis: Uma das principais preocupações da Agricultura Orgânica é o solo. O mundo presencia a maior perda de solo fértil pela erosão em função do uso inadequado de práticas agrícolas convencionais. Com a Agricultura Orgânica é possível reverter essa situação.
6) Água pura: Quando são utilizados agrotóxicos e grande quantidade de nitrogênio, ocorre a contaminação nas fontes de água potável. Cuidando desse recurso natural, garante-se o consumo de água pura para o futuro.
7) Biodiversidade: A perda das espécies é um dos principais problemas ambientais. A Agricultura Orgânica preserva sementes por muitos anos e impede o desaparecimento de numerosas espécies, incentivando as culturas mistas e fortalecendo o ecossistema. A Fauna permanece em equilíbrio e todos os seres convivem em harmonia, graças à não utilização de agrotóxicos. A Agricultura Orgânica respeita o equilíbrio da natureza e cria ecossistemas saudáveis.
8) Redução do aquecimento global e economia de energia: O solo tratado com substâncias químicas libera uma quantidade enorme de gás carbônico, gás metano e óxido nitroso. A agricultura e administração florestal sustentáveis podem eliminar 25% do aquecimento global. Atualmente, mais energia é consumida para produzir fertilizantes artificiais do que para plantar e colher todas as safras.
9) Custo social e ambiental: O alimento orgânico não é na realidade mais caro que o alimento convencional se consideramos que, indiretamente, estaremos reduzindo:
1) Gastos com MÉDICOS e MEDICAMENTOS
2) CUSTOS com a recuperação ambiental.
10) Cidadania e responsabilidade social: Consumindo orgânicos, estamos exercitando nosso papel social, contribuindo com a conservação e preservação do meio ambiente e apoiando causas sociais relacionadas com a proteção do trabalhador e com a eliminação da mão-de-obra infantil.
Hoje estarei na Radio Vinha FM (91,9) com um grupo de colegas: agrônomos e nutricionista falando sobre Orgânicos e suas vantagens. 12:30 no programa Mesa dos Notáveis.
Os agrotóxicos são usados no mundo desde a Década de 30, como por exemplo o DDT (sigla de Dicloro-Difenil-Tricloroetano), um inseticida barato e altamente eficaz a curto prazo. A longo prazo tem efeitos prejudiciais à saúde humana, pois permanece no ambiente por décadas. Foi banido de vários países por ser cancerígeno e atingir o sistema nervoso central e periférico como todos organoclorados.
Os organofosforados e carbamatos são uma classe de agrotóxicos bastante usada atualmente. Há estudos inconclusivos que mostram correlação com alterações musculares, efeito neurotóxico e ação disruptora endócrina (pode se ligar a receptores de hormônios e mimetizar a ação destes). Mensalmente são publicados artigos que evidenciam possíveis efeitos dos agrotóxicos para a saúde de seres vivos.
Penso da seguinte maneira: se há risco potencial, porquê consumir um alimento cultivado com agrotóxicos, se temos a opção orgânica ?
Orgânicos são alimentos plantados naturalmente sem o uso de nenhum pesticida como inseticidas, bactericidas, herbicidas, nematicidas, acaricidas, fungicidas de natureza física, química ou biológica. Resumindo: Orgânicos são produtos cultivados sem a adição de Agrotóxicos (ou como alguns chamam, Defensivos Agrícolas).
A produção de orgânicos sempre que possível, baseia-se:
1) No uso de estercos animais, 2) Rotação de culturas, 3) Adubação verde, 4) Compostagem e 5) Controle biológico de pragas e doenças.
Tem como principal objetivo a manutenção da estrutura do solo além da sua produtividade, gerando alimentos saudáveis e produzidos baseados em uma relação harmônica com a natureza (homem/natureza, homem/animais homem/homem). Por esses motivos, eu como médico e ecologista defendo essa causa. Alguns aspectos que sempre ressalto para quem me pergunta "Dr. porque vc está nessa de defender ecologia associada à medicina?":
1) Aspectos sanitários: alimentos orgânicos não possuem "defensivos" agrícolas sintéticos ou qualquer tipo de venenos que possa comprometer a saúde de qualquer ser na escala evolutiva, seja ele um invertebrado, seja ele um homo sapiens. Princípio este que jurei na minha formatura. Princípio este criado pelo pai da Medicina (Hipócrates) "primum non nocere" que significa em primeiro lugar não lesar.
2) Aspectos ecológicos: a agricultura orgânica por não utilizar métodos agressivos e nocivos para a natureza, evita a degradação do meio ambiente. Isso inclui: manutenção das características do solo (as vezes adubando através de rochagem, mas sem utilizar fertilizantes sintéticos), manutenção da potabilidade da água e pureza do ar. A agricultura orgânica geralmente é familiar e ocorre de forma sustentável, na qual se respeita ciclos milenares (plantio/colheita). Desenvolvimento e preservação ambiental andam de forma conjunta.
De formal geral, a agricultura orgânica é baseada em três idéias. São elas:
1) Cultivo natural: é proibido o uso de agrotóxicos, adubos químicos e artificiais e conservantes no processo de produção.
2) Equilíbrio ecológico: A produção respeita o equilíbrio microbiológico do solo e as diferentes épocas de safra. O processo fica mais sustentável, não degradando a biodiversidade.
3) Respeito ao homem: o trabalhador tem que ser respeitado (leis trabalhistas, ganho por produtividade, treinamento profissional e qualidade de vida).
Para se obter um alimento verdadeiramente orgânico, é necessário conhecer diversas ciências (agronomia, ecologia, nutrição, medicina, economia, entre outras). Assim, o agricultor, através de um trabalho harmonizado com a natureza, tem condições de oferecer ao consumidor alimentos que promovam não apenas a saúde deste último, mas também do planeta em que vivemos.
Será que é orgânico mesmo? Como saber?
Se você pretende consumir alimentos orgânicos fique atento para não ser enganado. Procure sempre pelo selo de qualidade emitido por certificadoras reconhecidas pelo Ministério da Agricultura. Para ganhar o selo, os produtores seguem várias precauções e têm suas lavouras fiscalizadas a cada semestre. A presença do selo garante, portanto, a procedência e a qualidade dos produtos.
Existem 10 principais motivos para se optar por orgânicos, são eles:
1) São mais nutritivos e saborosos: Com solos balanceados e fertilizados com adubos naturais, se obtém alimentos mais nutritivos. A comida fica mais saborosa, conservam-se suas propriedades naturais como vitaminas, sais minerais, carboidratos e proteínas. Em solos equilibrados as plantas crescem mais saudáveis, preservam-se suas características originais como aroma, cor e sabor. Consumindo produtos orgânicos é possível apreciar o sabor natural dos alimentos. Além disso, quando se utiliza o sistema de Rochagem na adubagem o alimento fica mais rico devido a inserção de minerais ESSENCIAIS na composição do solo. Algumas pesquisas internacionais (há pesquisas que dizem o contrário) demonstram que alimentos orgânicos apresentam, em média:
- 63% a mais cálcio, 73% mais ferro, 118% mais magnésio, 178% mais molibdênio, 91% mais fósforo, 125% mais potássio, 60% mais zinco que os alimentos convencionais. Possuem menor quantidade de mercúrio (29%), substancia que pode causar doenças graves (informação publicada no Journal of Applied Nutricion, 1993).
2) Sáude garantida: Como citei, agrotóxicos estão associados a diversas patologias, dentre elas:
1) Cânceres dos mais viversos tipos; 2) Alergias alimentares; 3) Asma; 4) Infertilidade; 5) Alterações hormonais principalmente quando se trata de hormônios sexuais; 6) Hiperatividade em adultos e crianças; 7) Déficit de atenção; 8) Doenças neurodegenerativas; 9) Aumento da produção de radicais livres e diminuição da produção de antioxidantes; 10) Intoxicação por metais pesados Um relatório da Academia Americana de Ciências, de 1982, calculou em 1.400.000 o número de novos casos de câncer provocados por agrotóxicos. Vale a pena ler um post que publiquei no meu blog sobre a recente pesquisa da Anvisa, na qual a mesma detectou irregularidade em 29% dos alimentos analisados. Veja também esse post sobre a Reavaliação de agrotóxicos e veja o quão grave é a situação.
3) Proteção às futuras gerações: As crianças são os alvos mais vulneráveis da agricultura com agrotóxicos. “Quando uma criança completa um ano de idade, já recebeu a dose máxima aceitável para uma vida inteira, de agrotóxicos que provocam câncer”, diz um relatório recente do Environmental Working Group (Grupo de Trabalho Ambiental). A agricultura orgânica, além disso mais, tem a grande tarefa de legar às futuras gerações um planeta reconstruído.
4) Respeito ao pequeno produtor: O trabalhador rural precisa ser preservado, tanto quanto a qualidade ecológica dos alimentos. Adquirindo produtos ecológicos, contribuímos com a redução da migração de famílias para as cidades, evitando o êxodo rural e ajudando a acabar com o envenenamento por agrotóxicos sofrido por cerca de 1 milhão de agricultores no mundo inteiro.
5) Solos mais férteis: Uma das principais preocupações da Agricultura Orgânica é o solo. O mundo presencia a maior perda de solo fértil pela erosão em função do uso inadequado de práticas agrícolas convencionais. Com a Agricultura Orgânica é possível reverter essa situação.
6) Água pura: Quando são utilizados agrotóxicos e grande quantidade de nitrogênio, ocorre a contaminação nas fontes de água potável. Cuidando desse recurso natural, garante-se o consumo de água pura para o futuro.
7) Biodiversidade: A perda das espécies é um dos principais problemas ambientais. A Agricultura Orgânica preserva sementes por muitos anos e impede o desaparecimento de numerosas espécies, incentivando as culturas mistas e fortalecendo o ecossistema. A Fauna permanece em equilíbrio e todos os seres convivem em harmonia, graças à não utilização de agrotóxicos. A Agricultura Orgânica respeita o equilíbrio da natureza e cria ecossistemas saudáveis.
8) Redução do aquecimento global e economia de energia: O solo tratado com substâncias químicas libera uma quantidade enorme de gás carbônico, gás metano e óxido nitroso. A agricultura e administração florestal sustentáveis podem eliminar 25% do aquecimento global. Atualmente, mais energia é consumida para produzir fertilizantes artificiais do que para plantar e colher todas as safras.
9) Custo social e ambiental: O alimento orgânico não é na realidade mais caro que o alimento convencional se consideramos que, indiretamente, estaremos reduzindo:
1) Gastos com MÉDICOS e MEDICAMENTOS
2) CUSTOS com a recuperação ambiental.
10) Cidadania e responsabilidade social: Consumindo orgânicos, estamos exercitando nosso papel social, contribuindo com a conservação e preservação do meio ambiente e apoiando causas sociais relacionadas com a proteção do trabalhador e com a eliminação da mão-de-obra infantil.
Hoje estarei na Radio Vinha FM (91,9) com um grupo de colegas: agrônomos e nutricionista falando sobre Orgânicos e suas vantagens. 12:30 no programa Mesa dos Notáveis.
Postado por
Dr. Frederico Lobo
às
20:59
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

quarta-feira, 9 de fevereiro de 2011
Chá verde e chá branco
Muito se fala sobre as propriedades funcionais do chá branco e verde, mas qual é a real diferença entre eles?
Tanto o chá verde, quanto o chá branco são produzidos a partir de um processo químico de oxidação (incorretamente chamado de fermentação) das folhas de uma planta chamada Camelia Sinensis.
Entretanto, a diferença entre esses dois chás é que o branco é colhido quando as folhas ainda estão bem jovens, ou seja, o que distingue um chá do outro é quando as folhas da planta são colhidas.
Além disso, os estudos comprovam que essas catequinas do chá branco são mais ativas que as catequinas de outros chás. Portanto, acredita-se que, por apresentarem maior concentração de catequinas, seu efeito é mais potente. Porém, vale ressaltar que os estudos sobre o consumo de chá branco em humanos são escassos.
As catequinas presentes nos chás obtidos da Camelia Sinensis são consideradas potentes antioxidantes e antiinflamatórios, pois inibem a ativação do fator NF-kB, que é um ativador da inflamação. Por isso, o consumo regular de chá verde oferece diversos efeitos protetores ao organismo, devido à redução do processo inflamatório de uma maneira geral.
Os estudos indicam que o consumo ideal de chá verde para garantir os benefícios das catequinas é de 4 a 5 xícaras ao dia. Porém, é importante lembrar que ele nunca deve ser reaquecido.
Ação anti-cancerígena do chá verde
Muitos estudos sugerem que o consumo de chá verde está relacionado com a diminuição do risco de diversos tipos de cânceres.
Uma meta-análise publicada em 2006 que avaliou estudos epidemiológicos encontrou que o consumo elevado do chá verde (> 5 xícaras/dia) foi associado com uma redução de 20% no risco de câncer de mama (risco relativo = 0,78, 95% intervalo de confiança [IC], 0,61 a 0,98).
Outra meta-análise também publicada em 2006 encontrou que o alto consumo de chá verde foi associado com uma redução de 18% no risco de câncer colorretal (risco relativo = 0,82; 95% IC, 0,69-0,98).
Os resultados mostraram que o grupo tratado apresentou redução significativa no peso corporal, índice de massa corporal, massa gorda e circunferência da cintura e do quadril (p < 0,05).
Um estudo de coorte prospectivo com mais de 40.000 adultos japoneses mostrou que o consumo de chá verde foi inversamente associado com a mortalidade por doença cardiovascular. As mulheres que consumiram cinco ou mais xícaras/dia apresentaram 31% menos mortalidade por doença cardiovascular.
Um estudo duplo-cego randomizado controlado por placebo com 240 adultos chineses com hipercolesterolemia leve a moderada analisou a suplementação diária do extrato de chá-verde enriquecido com teaflavina. O grupo suplementado apresentou redução de 16,4% nos níveis de LDL (lipoproteína de baixa densidade) e em 11,3% nos níveis de colesterol total em comparação com o grupo placebo.
Obs: Muitos pacientes me perguntam:
1) Dr, como preparo o chá verde?
2) Dr, o chá verde em saquinho tem efeito ??
3) Dr, qual é melhor , cápsula de chá verde ou o chá in natura ?
1 litro de água filtrada
1 rama de canela ou erva doce
Ferver de preferência em uma chaleira por no mínimo 5 minutos, até no máximo 10 minutos. Se for possível mexer com uma colher de pau.
Desligar o fogo, esperar esfriar um pouco e começar a tomar. Pode ser armazenado na geladeira por até 24 horas. Mas geralmente indo o seguinte: fazer cedo e tomar até as 14:00.
Atenção, evite de ingeri-lo próximo às refeições ou após pois os polifenóis impedem a absorção de cálcio, magnésio, ferro e zinco.
Para ler mais sobre o preparo: http://www.scielo.br/pdf/cta/v30s1/29.pdf
2 - Chá verde em sachê
Eu prefiro comprar o chá verde orgânico da mãe terra, a quantidade de chá verde no sachê é pouca, portanto faz-se necessário utilizar vários sachês.
3 - Cápsulas (extrato) ou in natura
Existem estudos comparativos e cada um tem suas vantagens. A cápsula tem a questão da comodidade, praticidade, porém o chá in natura (quando adicionado outras ervas ou sucos) pode ser saboroso e uma forma de aumentar a ingestão de água (algo muito comum entre meus pacientes, principalmente mulheres). Portanto estimulo o uso do chá in natura.
Apenas a título de curiosidade:
Obs: Para ler mais sobre Antioxidantes no blog, veja o post: http://www.ecologiamedica.net/2010/11/antioxidantes.html
Tanto o chá verde, quanto o chá branco são produzidos a partir de um processo químico de oxidação (incorretamente chamado de fermentação) das folhas de uma planta chamada Camelia Sinensis.
Entretanto, a diferença entre esses dois chás é que o branco é colhido quando as folhas ainda estão bem jovens, ou seja, o que distingue um chá do outro é quando as folhas da planta são colhidas.
As pesquisas indicam que o chá branco, por ter folhas mais jovens, possui maior concentração de catequinas, que são as principais substâncias ativas do chá branco e do chá verde.
Além disso, os estudos comprovam que essas catequinas do chá branco são mais ativas que as catequinas de outros chás. Portanto, acredita-se que, por apresentarem maior concentração de catequinas, seu efeito é mais potente. Porém, vale ressaltar que os estudos sobre o consumo de chá branco em humanos são escassos.
A maior parte dos estudos descrevem fitoquímicos presentes no Chá verde. Como já foi dito acima, consiste em um produto obtido a partir da planta Camellia sinensis, contém mais de 200 compostos, em que os mais conhecidos e mais abundantes são os polifenóis. Estes incluem:
- Epicatequinas (EC),
- Epigalocatequinas (EGC),
- Epicatequina-3-galato (ECG),
- Epigalocatequina-3-galato (EGCG)
As catequinas presentes nos chás obtidos da Camelia Sinensis são consideradas potentes antioxidantes e antiinflamatórios, pois inibem a ativação do fator NF-kB, que é um ativador da inflamação. Por isso, o consumo regular de chá verde oferece diversos efeitos protetores ao organismo, devido à redução do processo inflamatório de uma maneira geral.
Os estudos indicam que o consumo ideal de chá verde para garantir os benefícios das catequinas é de 4 a 5 xícaras ao dia. Porém, é importante lembrar que ele nunca deve ser reaquecido.
Ação anti-cancerígena do chá verde
Muitos estudos sugerem que o consumo de chá verde está relacionado com a diminuição do risco de diversos tipos de cânceres.
Uma meta-análise publicada em 2006 que avaliou estudos epidemiológicos encontrou que o consumo elevado do chá verde (> 5 xícaras/dia) foi associado com uma redução de 20% no risco de câncer de mama (risco relativo = 0,78, 95% intervalo de confiança [IC], 0,61 a 0,98).
Outra meta-análise também publicada em 2006 encontrou que o alto consumo de chá verde foi associado com uma redução de 18% no risco de câncer colorretal (risco relativo = 0,82; 95% IC, 0,69-0,98).
Outros estudos avaliaram a relação entre o chá verde e câncer de próstata. Um estudo científico controlado acompanhou 60 pacientes com neoplasia intraepitelial prostática de alto grau (NIP, lesão benigna). Os pacientes foram agrupados de forma aleatória para receber durante um ano o extrato de catequinas do chá verde (200 mg, 3x/dia) ou placebo. Trinta por cento dos pacientes do grupo placebo (n=9) evoluíram para o câncer de próstata, enquanto que no grupo chá verde foi de apenas 3% (n=1). Um estudo epidemiológico com cerca de 50.000 homens japoneses mostrou uma relação dose-dependente entre o consumo de chá verde e redução no risco de câncer de próstata avançado.
Ação no Sobrepeso/Obesidade
Estudos clínicos têm analisado o efeito do chá verde na perda e na manutenção do peso. Um estudo duplo-cego e controlado comparou os efeitos da ingestão do extrato de chá verde em 240 adultos japoneses obesos.
Os resultados mostraram que o grupo tratado apresentou redução significativa no peso corporal, índice de massa corporal, massa gorda e circunferência da cintura e do quadril (p < 0,05).
Ação nas doenças cardiovasculares
Estudos epidemiológicos sugerem que a ingestão de chá verde está associada a um menor risco de doenças cardiovasculares.
Um estudo de coorte prospectivo com mais de 40.000 adultos japoneses mostrou que o consumo de chá verde foi inversamente associado com a mortalidade por doença cardiovascular. As mulheres que consumiram cinco ou mais xícaras/dia apresentaram 31% menos mortalidade por doença cardiovascular.
Um estudo duplo-cego randomizado controlado por placebo com 240 adultos chineses com hipercolesterolemia leve a moderada analisou a suplementação diária do extrato de chá-verde enriquecido com teaflavina. O grupo suplementado apresentou redução de 16,4% nos níveis de LDL (lipoproteína de baixa densidade) e em 11,3% nos níveis de colesterol total em comparação com o grupo placebo.
Fontes:
1 - VP Consultoria Nutricional
2 - Artigo da Dra. Rita de Cássia Borges de Castro (publicado no Nutritotal)
1 - VP Consultoria Nutricional
2 - Artigo da Dra. Rita de Cássia Borges de Castro (publicado no Nutritotal)
Obs: Muitos pacientes me perguntam:
1) Dr, como preparo o chá verde?
2) Dr, o chá verde em saquinho tem efeito ??
3) Dr, qual é melhor , cápsula de chá verde ou o chá in natura ?
Bem, vamos por partes.
1 - Preparo do cháTem gente que é leiga e não sabe o que está falando quando afirma que o chá tem q ser feito em infusão. Tem estudos mostrando que infusão por até 10 minutos e manutenção em geladeira por até 24h não ocasiona perda dos polifenóis e catequinas. Portanto vai aí a dica pra preparar um chá verde saboroso:
1 colher de sobremesa de chá verde ( +- 10g)1 litro de água filtrada
1 rama de canela ou erva doce
Ferver de preferência em uma chaleira por no mínimo 5 minutos, até no máximo 10 minutos. Se for possível mexer com uma colher de pau.
Desligar o fogo, esperar esfriar um pouco e começar a tomar. Pode ser armazenado na geladeira por até 24 horas. Mas geralmente indo o seguinte: fazer cedo e tomar até as 14:00.
Atenção, evite de ingeri-lo próximo às refeições ou após pois os polifenóis impedem a absorção de cálcio, magnésio, ferro e zinco.
Para ler mais sobre o preparo: http://www.scielo.br/pdf/cta/v30s1/29.pdf
2 - Chá verde em sachê
Eu prefiro comprar o chá verde orgânico da mãe terra, a quantidade de chá verde no sachê é pouca, portanto faz-se necessário utilizar vários sachês.
3 - Cápsulas (extrato) ou in natura
Existem estudos comparativos e cada um tem suas vantagens. A cápsula tem a questão da comodidade, praticidade, porém o chá in natura (quando adicionado outras ervas ou sucos) pode ser saboroso e uma forma de aumentar a ingestão de água (algo muito comum entre meus pacientes, principalmente mulheres). Portanto estimulo o uso do chá in natura.
Apenas a título de curiosidade:
- Obesidade: o chá in natura tem efeito maior que o extrato, mas o efeito no índice de massa corpórea (IMC) é igual para os dois.
- A pressão arterial diastólica reduziu nos dois.
- Triglicerídeos reduziram com o chá in natura e não reduziram tanto com o extrato.
Dr. Frederico Lobo
Obs: Para ler mais sobre Antioxidantes no blog, veja o post: http://www.ecologiamedica.net/2010/11/antioxidantes.html
Postado por
Dr. Frederico Lobo
às
23:38
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

Marcadores:
camelia sinensis,
catequinas,
chá branco,
chá verde,
polifenóis
quarta-feira, 23 de novembro de 2022
[Conteúdo exclusivo para médicos e nutricionistas] - O valor calórico das carnes de gado, porco, frango e peixe são iguais?
Por definição, “carne” é o produto advindo das porções comestíveis de animais domésticos, selvagens ou de criação, que servem de alimento ao homem. No Brasil, os tipos de carne mais consumidos incluem as carnes de aves, bovinas e suínas, além dos pescados. Neste artigo, você irá entender as diferenças entre os valores calóricos e nutricionais das carnes mais consumidas em nosso país.
Valor calórico e nutricional dos tipos de carne
Basicamente, a estrutura das carnes envolve a presença de três tecidos distintos: o muscular, o conjuntivo e o adiposo. Já os órgãos internos, normalmente chamados de vísceras, também podem ser classificados como carne.
Em geral, as carnes são fontes de proteínas de alto valor biológico (10 a 20%), gorduras (5 a 30%), vitaminas (principalmente A, complexo B, D, e K) e minerais (principalmente ferro, cálcio, sódio e potássio).
Contudo, a composição de cada carne varia de acordo com a raça do animal, tipo de ração ingerida, condições climáticas, corte e preparo culinário. Esses fatores conferem uma diferença considerável em suas propriedades nutricionais e sensoriais.
O valor calórico fornecido pelas carnes depende principalmente da quantidade de proteínas e gorduras, uma vez que a quantidade de carboidratos nas carnes é irrelevante. Cortes diferentes do mesmo animal possuem valor calórico diverso.
A seguir, você encontra o teor calórico e nutricional dos diferentes tipos e preparos de carne consumidos pela população brasileira.
Carne bovina
As carnes bovinas fazem parte do grupo de carnes vermelhas, e são obtidas a partir das musculaturas dos bovinos, principalmente do gado doméstico.
Estes produtos fornecem ótimos níveis de proteína, além de micronutrientes como zinco, ferro, fósforo, potássio, magnésio, e vitaminas do completo B. Porém, é preciso tomar cuidado com a alta quantidade de gorduras saturadas e colesterol.
Diferentes músculos bovinos fornecem corte de carne com características sensoriais distintas. As regiões mais ricas em gordura fornecem carnes mais macias, sendo consideradas “carnes gordas” (quando a quantidade de gordura excede em 50% o valor calórico). Picanha e acém são exemplos.
Já as musculaturas submetidas a maiores esforços fornecem carnes mais duras, com maior conteúdo de tecido conectivo: são as “carnes magras”, como lagarto, filé-mignon e patinho. Neste caso, a quantidade de gordura não excede em 50% o valor calórico proveniente desta gordura.
Na tabela a seguir, estão apresentados os teores de calorias dos diferentes tipos de carnes bovina, da menos calórica para a mais calórica. Níveis de proteínas, gorduras totais, gorduras saturadas e colesterol também foram incluídos, para melhor orientar a prescrição nutricional.
Carne suína
A carne suína, ou carne de porco, também integra o grupo das carnes vermelhas. Muito comum em preparações regionais (como feijoada, virado à paulista ou feijão tropeiro), a carne suína possui quantidades de colesterol similares às da carne bovina. Além da proteína, também contém níveis consideráveis de vitaminas A e B2, cálcio, ferro e fósforo.
É uma carne rosada, firme, com gordura branca e consistente, mais macia do que a gordura da carne bovina. Se for de qualidade inferior, apresenta muita gordura; porém, depende do corte.
Novamente, por integrar o grupo das carnes vermelhas, é preciso ter cautela com seu consumo: em uma metanálise recente, o consumo destes produtos foi positivamente associado ao aumento do câncer gástrico.
A tabela abaixo expressa o teor de nutrientes a cada 100 g de diferentes cortes suínos (em ordem crescente para o teor calórico).
Carne de frango
As carnes de aves integram as carnes brancas, sendo as mais consumidas mundialmente, em especial o frango. Contudo, carnes de outros animais (como peru, codorna e chester) também são apreciados por muitos.
Quanto ao valor nutritivo, possuem conteúdo protéico semelhante às outras carnes, com menos gordura e menos colesterol, além de serem fontes de cálcio, ferro, fósforo, potássio e zinco. Recomenda-se a retirada da pele para reduzir ainda mais a quantidade de gordura existente.
Os cortes de peito tem menor teor de gordura, enquanto a coxa, sobrecoxa e asa são partes um pouco mais gordurosas. Além disso, miúdos como fígado, coração e moela também são consumidos, além de pé e pescoço.
Compare o teor calórico dos cortes de aves (a cada 100 g) na tabela abaixo:
Carne de peixe
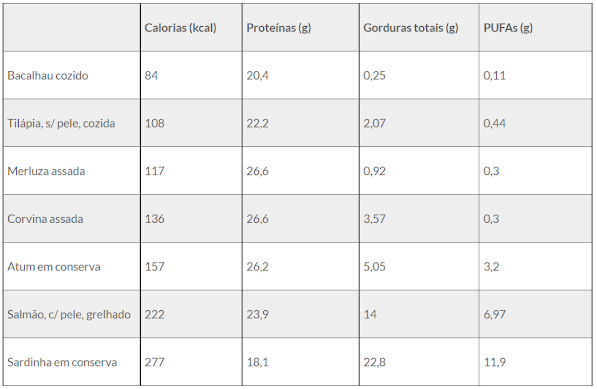
Os pescados são todos os animais aquáticos que servem de alimento para o homem, obtidos de água doce ou salgada, por diferentes processos de captura ou pesca. São divididos entre os peixes e os frutos do mar.
Os peixes, por sua vez, podem ser gordurosos e de músculo escuro (como atum, sardinha, bagre ou salmão), ou peixes de carne clara (como bacalhau, carpa e dourado). De forma geral, são fontes de proteínas de alto valor biológico e de ômega 3. Os peixes de água salgada são ótimas fontes de iodo e cálcio, além do óleo de fígado ser uma excelente fonte de vitaminas A e D.
Abaixo, apresentamos o teor calórico e nutricional dos peixes mais consumidos a cada 100 g.
Conclusão
Como visto, o valor calórico dos diferentes tipos de carne não é igual. Cortes mais gordurosos, como picanha, alcatra e costela suína, costumam ter mais calorias. No plano nutricional, esse fator deve ser considerado, principalmente para pacientes que estão em busca do emagrecimento.
Leia também:
Quais são as diferenças nutricionais entre as carnes bovina, suína, de frango e de peixe? https://nutritotal.com.br/pro/o-valor-cala-rico-das-carnes-de-gado-porco-frango-e-peixe-sa-o-iguais/
Consumo de carne vermelha e processada aumenta risco de câncer colorretal: https://nutritotal.com.br/pro/consumo-de-carne-vermelha-e-processada-aumenta-risco-de-cancer-colorretal/
Consumo de peixe durante a gestação beneficia o desenvolvimento neurológico do feto: https://nutritotal.com.br/pro/consumo-de-peixe-durante-a-gestaa-a-o-beneficia-o-desenvolvimento-neurola-gico-do-feto/
Referências
- AHMAD, Rabia Shabir; IMRAN, Ali; HUSSAIN, Muhammad Bilal. Nutritional composition of meat. Meat science and nutrition, v. 61, n. 10.5772, 2018.
- Domene. Técnica Dietética – Teoria e Aplicações. Guanabara: Rio de Janeiro, 2018.
- KIM, Seong Rae et al. Effect of red, processed, and white meat consumption on the risk of gastric cancer: an overall and dose–response meta-analysis. Nutrients, v. 11, n. 4, p. 826, 2019.
- McGee, H. Comida e cozinha: Ciência e cultura da culinária. Martins Fontes: São Paulo, 2016.
- MOREIRA, Leise Nascimento. Técnica Dietética. Estácio, Rio de Janeiro: SESES, 2016
- TBCA – Tabela Brasileira de Composição de Alimentos.
Postado por
Dr. Frederico Lobo
às
19:55
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

quarta-feira, 21 de março de 2012
Açúcar, o doce veneno ?
Segundo o dicionário, veneno é uma substância que perturba ou destrói as funções vitais. Também se sabe que a diferença entre o remédio e o veneno está na dose. Sendo assim, o açúcar (sacarose) se enquadra bem na definição de veneno se considerarmos seus efeitos e os infindáveis alimentos em que ele está presente e que são consumidos quase que diariamente pela maioria das pessoas: bolachas, pães, molhos, doces, sobremesas, bebidas como refrigerantes, sucos, chás etc.
Para ser metabolizado, o açúcar “rouba” vitaminas do complexo B, bloqueia o metabolismo de minerais como o magnésio, promove descalcificação e torna o estômago e o sangue mais ácidos. Tais eventos podem abrir porta para a osteoporose e para a diminuição das defesas do organismo, além de inflamações.
Quando digerido, o açúcar se transforma rapidamente em glicose e é jogado na corrente sanguínea: o sangue fica com sobrecarga de glicose. Logo, o pâncreas produz muita insulina para jogar a glicose do sangue para dentro da célula. Quando isto acontece, há uma queda brusca de glicose no sangue e uma situação de hipoglicemia que pode gerar ansiedade, nervosismo, dor de cabeça, cansaço, fraqueza, confusão mental ou sono.
Sem sombra de dúvidas, o cérebro é um dos grandes afetados pelo açúcar. Estudos atuais vem demonstrando as conseqüências da sua ingestão habitual: declínio mental, déficit de atenção, diminuição na capacidade de aprendizagem, depressão, síndrome do pânico e instabilidade emocional.
O açúcar também é uma das grandes causas da obesidade, já que a glicose em excesso é depositada na forma de gordura. Estudos comprovam que ele pode atuar no desenvolvimento de diabetes, síndrome metabólica, doenças cardiovasculares e outras enfermidades. Além disso, a sobrecarga de glicose no sangue propicia a formação excessiva de radicais livres, gerando stress oxidativo e, consequentemente, podendo desencadear o envelhecimento precoce, artrite e doenças de Alzheimer e Parkinson.
Sabemos que o produto final da digestão dos carboidratos é a glicose. Então, os outros alimentos que contém carboidratos (massas, pães, frutas etc) desencadearão efeitos semelhantes aos do açúcar? Se forem alimentos refinados (farinhas brancas) os efeitos serão semelhantes aos do açúcar. Mas os alimentos integrais e frutas possuem fibras que aumentam o tempo de trânsito intestinal, aumentam a viscosidade e formam géis que retardam a absorção de glicose, impedindo sua sobrecarga abrupta no sangue bem como a produção excessiva de insulina. E também, os alimentos integrais possuem nutrientes como vitaminas e minerais, que auxiliam na metabolização do alimento sem “roubar” os estoques do corpo.
Isso tudo não é radicalização e sim, a realidade: o açúcar realmente pode pertubar as funções vitais. Reflita sobre tais informações, examine e pense na melhor forma de diminuir ou retirar o açúcar da sua dieta – sinta os benefícios e veja se vale à pena!
Postado por
Dr. Frederico Lobo
às
20:02
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

quinta-feira, 10 de novembro de 2011
Conhecendo as Sementes de Chia!
O texto abaixo foi elaborado pela Dr. Carol Morais, nutricionista especialista em nutrição funcional.
O mesmo foi publicado no Blog da VP
SEMENTE DE CHIA
A semente de chia é a nova “comprovação” da ciência em termos de alimento saudável. Por essa razão ela vem aparecendo em várias reportagens e blogs sobre alimentação, como por exemplo, na sessão Prato Saudável da revista Boa Forma de outubro de 2011. Os principais benefícios já relatados são, principalmente, sobre as sementes da planta Salvia Hispanica ou chia, como está sendo mais chamada.
A Salvia Hispânica é uma planta originária da região andina do México e da Guatemala, com sementes ovais e pequenas de coloração variada (preta, marrom escura, branca ou cinza). Reza a lenda que os guerreiros maias consumiam apenas um punhado de suas sementes e guerreavam por 2 dias – por essa razão o nome chia, que significa força. Eles valorizavam tanto essas sementes que a utilizavam também como moeda.
Lendas à parte, os estudos de composição demonstraram que a semente parece ser uma boa fonte de ômega 3, antioxidantes, fibras e aminoácidos. Segundo a literatura, a composição varia de acordo com a origem da semente. Por exemplo, o teor proteico e a concentração de ômega 3 é maior nas sementes que crescem em regiões mais secas.
O perfil de aminoácidos (Isoleucina, Leucina, Valina, Lisina, Metionina, Fenilalanina, Treonina, Triptofano) da semente de chia permite que ela seja uma boa opção como fonte proteica.
Outra vantagem da semente é sua atuação no estômago, parecido com as mucilagens, que promove uma conversão mais lenta de carboidratos em açúcar, podendo ser, dessa forma, utilizado no auxílio do controle da glicemia sanguínea. Um estudo canadense1 evidenciou um auxílio na manutenção de um bom controle glicêmico e lipídico em pacientes portadores de diabetes tipo 2, previamente compensados.
Já um estudo feito em ratos mostrou que animais submetidos à dieta rica em sucrose, porém recebendo semente de chia, não desenvolveram hiperlipidemia nem resistência insulínica, mas os níveis glicêmicos não se alteraram. Os autores acreditam que isso seja decorrente da presença de ácido linolênico.
Por apresentar uma boa concentração de ácido linolênico, consiste em uma ótima fonte vegetal de ômega 3. Apresenta ainda os seguintes ácidos graxos: alfa-linoleico, oleico, esteárico, palmítico. Na literatura há estudos evidenciando que a suplementação de 3,7 a 4 gramas/dia reduziu a pressão arterial sistólica, níveis de PCR ultra-sensível e fator de Von Willebrand, além de elevar os níveis plasmáticos de EPA.
Por ser uma das principais fontes vegetais de ômega 3, torna-se um alimento auxiliar no tratamento de pacientes portadores de alergias, dislipidemias, insuficiência coronariana, risco cardiovascular elevado, diabetes tipo 2, situações em que há presença de resistência insulínica e/ou distúrbios endócrinos. Entretanto, não há estudos científicos mostrando resultados em obesidade.
A presença de alguns antioxidantes (ácido clorogênico, ácido cafeico, miricetina, quercetina e flavonoides) torna a semente de chia um alimento com potencial anti-inflamatório, podendo ser utilizado em situações caracterizadas pela inflamação crônica. Estudos epidemiológicos indicam que um consumo adequado de flavonoides pode atuar positivamente na prevenção de algumas doenças, como as cardiovasculares, embolia, câncer de pulmão e de estômago.
Com relação à sua estabilidade, a oxidação na chia é de mínima a nula, mantém um grande potencial dentro da indústria alimentícia, comparada com outras fontes de ácido graxo alfa-linolênico, como a linhaça, que mostra uma decomposição rápida devido à ausência de antioxidantes próprios da semente.
Além do perfil de ácidos graxos, a chia possui boa concentração de minerais (potássio, cálcio, ferro, magnésio e fósforo), além de vitaminas (vitamina A, tiamina, riboflavina, nianica, cobalamina, ácido ascórbico e alfa-tocoferol).
Diante de todas essas vantagens, esse alimento pode ser visto como mais um coadjuvante na busca pela saúde e não como redentor e único responsável por um bom estado de saúde. Afinal, saúde é um estado dependente de vários fatores.
*Texto elaborado pela Dra Carol Morais, aluna bolsista do curso de Pós-graduação em Nutrição Esportiva Funcional pela VP Consultoria Nutricional/ Divisão Ensino e Pesquisa.
____________________________________________________
Postado por
Dr. Frederico Lobo
às
22:40
3
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

terça-feira, 6 de outubro de 2015
Orientações nutrológicas para distúrbios labirínticos
Os hábitos alimentares inadequados e a indisciplina alimentar demonstram ser as principais causas do aumento dos problemas metabólicos. Os sinais e sintomas da disfunção labiríntica parecem estar entre as primeiras queixas dos pacientes com diabetes latente ou diminuição da tolerância à glicose. Observa-se que, uma parcela significativa dos indivíduos atendidos em nossa população ambulatorial, com queixas de sintomas relacionados ao equilíbrio e audição, são portadores de distúrbios no metabolismo dos carboidratos.
Ao longo dos anos, vêm-se observando que o tratamento dietético pode reduzir de forma acentuada, os sintomas da disfunção labiríntica. Com base nesta observação, buscamos revisar a literatura de forma a avaliar a relação entre o manejo dietético e o controle da função labiríntica. De forma geral, a literatura concorda com a nossa observação de que o tratamento dietético pode diminuir os sintomas da disfunção labiríntica, proporcionando o alívio para o paciente e melhorando a sua qualidade de vida.
As queixas vestibulares e auditivas têm, freqüentemente, sido associadas ao metabolismo anormal dos carboidratos e dos lipídios. Estima-se que a ocorrência dos distúrbios do metabolismo dos carboidratos, esteja entre 42% a 80% dos pacientes portadores de zumbidos e tonturas e, se percebe a nítida necessidade de demonstrar o impacto destes distúrbios sobre o funcionamento da orelha interna, pois nos parece evidente a melhora dos sintomas com a instituição da dieta.
LABIRINTOPATIA METABÓLICA
Diversas condições metabólicas afetam intensamente o funcionamento do ouvido interno. Estas são capazes de determinar o aparecimento de alterações labirínticas que, na maioria dos casos, são decorrentes de distúrbios no metabolismo de carboidratos (SILVA, 2000).
A condição metabólica mais freqüentemente relacionada à disfunção da orelha interna refere-se aos distúrbios na secreção da insulina, com ou sem hipoglicemia reativa concomitante.
As estruturas labirínticas apresentam atividade metabólica intensa, sendo altamente sensíveis aos níveis de oxigênio, glicose e ATP (Adenosina Trifosfato). O labirinto é particularmente sensível a pequenas variações nos níveis plasmáticos de glicose e insulina. Tanto a hipoglicemia quanto a presença de altos níveis de insulina interferem na atividade enzimática responsável pelo potencial endococlear (BITTAR, 2004).
Nas labirintopatias ou afecções vestibulococleares, os sintomas mais freqüentes, em pacientes com hiperinsulinemia, são a vertigem típica, associada a sintomas auditivos, como tinnitus, sensação de plenitude auricular, disacusia e cefaléia, limitando a qualidade de vida do indivíduo. É notável que os antecedentes pessoais e familiares dos portadores de labirintopatia metabólica revelam hábitos de alimentação inadequados, sedentarismo e tendência familiar para doenças como diabetes, hipertensão arterial e distúrbios hormonais (SILVA, 2000). De acordo com Ganança (1995), dois terços dos casos ocorrem em pessoas do sexo feminino, na faixa etária compreendida entre os 35 e 55 anos (80% dos casos), com tendência à obesidade , queixa de crises vertiginosas, já tendo sido submetidas a diversos especialistas, apresentando melhora parcial no início, porém sem resultado a longo prazo.
É evidente que, nos distúrbios metabólicos sistêmicos, o labirinto é atingido precocemente, sinalizando a necessidade de intervenção. Em relação à orientação terapêutica, o distúrbio deve ser diagnosticado e corrigido. Na maioria das vezes a correção requer orientação alimentar.
A HIPERINSULINEMIA COMO FATOR DESENCADEANTE DA LABIRINTOPATIA
Os carboidratos constituem a fonte mais importante de energia do organismo sendo que o principal carboidrato é a glicose (CINGOLANI, 2004). Os carboidratos são ingeridos com a dieta, principalmente na forma de polissacarídeos (amido) e dissacarídeos (sacarose e lactose). Após a sua digestão, os carboidratos passam para a circulação como monossacarídeos. Os monossacarídeos glicose, frutose e galactose são absorvidos, através da mucosa intestinal, e chegam até o fígado através da veia porta (CINGOLANI, 2004). O fígado libera glicose na corrente sangüínea, onde seu nível é mantido por ações dos hormônios. A elevação dos níveis séricos de glicose estimula insulina, que retira glicose da corrente sangüínea para as células (LIPPINCOTT, 2004).
Dentre os distúrbios do metabolismo do açúcar aceitos atualmente como responsáveis por alterações labirínticas, estão as disfunções metabólicas da glicose, incluindo diabetes, hipoglicemia reativa e hiperinsulinemia (BITTAR, 2004). A secreção de insulina, que é constante, pode ser modificada de acordo com estímulos específicos que podem aumentar ou diminuir sua taxa secretória (DOUGLAS, 2002). Além dos neurotransmissores e hormônios, os nutrientes constituem-se estímulo para a secreção insulínica. Os níveis aumentados de insulina resultam na redução da oferta de oxigênio para as células, o que induz prejuízo à função auditiva (BITTAR, 2003).
A insulina e, secundariamente, a glicose, seriam fundamentais na produção energética e ao adequado funcionamento da bomba de sódio e potássio. Ao nível celular e bioquímico isto se explica pela composição dos líquidos labirínticos: a endolinfa, é rica em potássio e pobre em sódio. A perilinfa, ao contrário, é rica em sódio e pobre em potássio (FERREIRA JÚNIOR, 2000). Como os líquidos são separados por uma membrana permeável, existe uma tendência às trocas dos líquidos gerando hipernatremia na endolinfa, deslocando água para este compartimento, provocando vertigem, zumbido, hipoacusia e plenitude auricular (FERREIRA JÚNIOR, 2000).
Com o adequado fornecimento de energia, obtida pela oxidação da glicose, o sódio retorna à perilinfa em troca de potássio, evitando as alterações clínicas citadas. Portanto, para manter o equilíbrio da bomba de sódio e potássio é necessário um aporte adequado de glicose e oxigênio, pois é através dessas duas substâncias que haverá a liberação de energia essencial para o funcionamento adequado do ouvido interno.
Do contrário, o aporte insuficiente de energia, gerado pela hiperinsulinemia, provoca a inativação da bomba de sódio e potássio o que, segundo Silva (2000), resulta também em queixas relativas à intolerância a sons, dificuldade de concentração, tendência à obesidade, irritabilidade, sonolência matinal e migrânea.
OS ALIMENTOS NO CONTROLE DA INSULINEMIA
Quando nos alimentamos, o processo de absorção dos nutrientes ocorre de forma gradual e contínua, aproximadamente 20 minutos após o início da refeição (POIAN, 2005). Após uma refeição, podem ser observados níveis plasmáticos de glicose alcançando o dobro dos níveis basais. Daí a importância de que a secreção de insulina ocorra também de forma gradual, acompanhando as oscilações dos níveis plasmáticos de glicose (POIAN, 2005).
O estímulo à secreção de insulina se dá por diversos fatores e qualquer desequilíbrio na concentração fisiológica de glicose plasmática pode determinar alterações e danos em vários tecidos/órgãos (POIAN, 2005).
O aumento na incidência de diabetes evidencia uma inabilidade gradual do pâncreas na produção de elevadas concentrações de insulina ao longo da vida.
Segundo Fukuda (2003), o consumo de sacarose tem sido exagerado nas últimas décadas e nosso organismo não teve o tempo necessário para adaptar-se às elevadas quantias ingeridas. O resultado dessa inadequação é a hiperinsulinemia com conseqüente hipoglicemia reativa e sintomas como cefaléia, sonolência, tonturas, etc (BITTAR, 2004).
A absorção de alimentos contendo carboidratos depende de sua complexidade estrutural, seu teor de fibras e sua apresentação. Isto resulta em graus variáveis de absorção da glicose neles contidos (COSTA, 2004). A intervenção nutricional nos distúrbios do metabolismo dos carboidratos, prevê o controle tanto do índice glicêmico dos alimentos utilizados na dieta quanto da carga glicêmica presente em cada refeição. O índice glicêmico de um alimento está relacionado ao impacto de sua composição na glicemia (alto, moderado ou baixo) após a sua ingestão. Já a carga glicêmica está relacionada ao impacto resultante do volume ingerido (alto, médio ou baixo). Um alimento que apresenta alto índice glicêmico, não necessariamente vai representar alta carga glicêmica na refeição, se a quantidade ingerida estiver sob controle. Na prática clínica, observa-se que, uma dieta com baixa carga glicêmica reduz os lipídios sangüíneos em indivíduos hipertrigliceridêmicos; reduz a secreção de insulina e melhora o controle global da glicemia em pacientes diabéticos insulino-dependentes e não insulino-dependentes.
O incremento de alimentos ricos em fibras solúveis e o adequado fracionamento das refeições, também buscam retardar a taxa de liberação de nutrientes no organismo, com repercussão positiva no controle dos distúrbios metabólicos. Quanto maior o teor de fibras do alimento e o retardo do esvaziamento do estômago, menor será a elevação da glicose no sangue após sua ingestão. Por outro lado, de acordo com Costa, 2004, a “pré-digestão” dos alimentos (amassar, triturar, esmagar, ralar e o excessivo cozimento) pode facilitar e aumentar a absorção da glicose. Neste caso, a alteração do índice glicêmico, é dependente dos outros alimentos ingeridos na mesma refeição e do modo de preparo dos mesmos.
Além do controle da quantidade, da qualidade, da freqüência e da combinação dos alimentos, é fundamental que sejam excluídos dos hábitos alimentares e de vida o consumo de álcool, da cafeína e o uso do tabaco, por conterem substâncias estimulantes da liberação da insulina.
Shils (2003) afirma que diferentes indivíduos podem ter respostas glicêmicas vastamente diferentes a um alimento, dependendo do seu estado de tolerância à glicose, idade e peso. Uma das mais eficazes opções terapêuticas parece ser a utilização de dietas nutricionais adequadas a cada caso, para que o tratamento seja dirigido à causa do distúrbio.
A PARTICIPAÇÃO DA DIETA NO CONTROLE DA LABIRINTOPATIA METABÓLICA
A dieta é a principal arma no combate aos sintomas causados por alterações do metabolismo da glicose ou da insulina. Está bem estabelecido que 90% dos pacientes submetidos a orientações dietéticas têm alívio ou cura dos sintomas (BITTAR, 1998 apud Mangabeira-Albernaz (1984).
Na prática clínica, observa-se que, durante o tratamento, os indivíduos com distúrbio labiríntico e alterações na curva insulinêmica, têm os sintomas reduzidos, em diferentes graus de intensidade. Entre três e seis meses de acompanhamento os mesmos desaparecem, quase em sua totalidade.
Nota-se, também, que os sintomas mais freqüentes e mais beneficiados com o uso da dieta são a cefaléia, a tontura, a sonolência e a plenitude auricular. Após a avaliação dos indivíduos, conclui-se que a maioria dos casos está relacionada a vícios nutricionais comuns.
Acredita-se que a intervenção nutricional precoce, em indivíduos que apresentam distúrbios da audição e do equilíbrio de origem metabólica, pode ser eficaz na redução ou mesmo no desaparecimento dos sintomas, contribuindo para o alívio do paciente e para uma melhor qualidade de vida. Um controle metabólico adequado pode retardar o aparecimento ou a progressão de complicações crônicas.
REFERÊNCIAS
BITTAR, R. S. M.; BOTTINO, M. A.; VENOSA, A. et al. 2004. Vestibular impairment secondary to glucose metabolic disorders: reality or myth? Revista Brasileira de Otorrinolaringologia, v.70, n.6, nov/dez. São Paulo. 801-6.
BITTAR, R. S. M.; BOTTINO, M. A.; ZERATI, F.E. et al. 2003. Prevalência das alterações metabólicas em pacientes portadores de queixas vestibulares. Revista Brasileira de Otorrinolaringologia. v.69, n.1 jan/fev. São Paulo.
BITTAR, R. S. M; SANCHEZ, T. G.; SANTORO, P.P et al. 1998. O metabolismo da glicose e o ouvido interno. Arquivos Internacionais de Otorrinolaringologia. V.2 Ed.1. São Paulo. 112-20.
CINGOLANI, G. C. 2004. Metabolismo dos carboidratos. In: CINGOLANI, H. E.; HOUSSAY, A. B. Fisiologia humana de Houssay. 7. ed. Porto Alegre: Artmed. 508-16.
COSTA, A. A; ALMEIDA NETO, J. S. 2004. Manual de diabetes: educação, alimentação, medicamentos, atividades físicas. 4. ed. São Paul Sarvier.
DOUGLAS, Carlos R. 2002. Tratado de fisiologia aplicada à nutrição. São Paul Robe Editorial.
LIPPINCOTT, W. & W. 2004. Nutriçã incrivelmente fácil. Rio de Janeir GUANABARA KOOGAN.
FERREIRA JÚNIOR, C. A.; GUIMARÃES, R. E. S.; BECKER, H. M. G et al. 2000. Avaliação metabólica do paciente com labirintopatia. Arquivos da Fundação Otorrinolaringologia, São Paulo, v.4, n.1 jan/fev/mar.
FUKUDA, Y. 2003. Otorrinolaringologia. Guias de medicina ambulatorial e hospitalar. São Paul Manole.
GANANÇA, M. M.; FUKUDA, Y. 1995. Labirintopatias vasculares e metabólicas. In: HUNGRIA H. Otorrinolaringologia. 7 ed. 393-401. Rio de Janeir GUANABARA KOOGAN. 393-401.
MANGABEIRA-ALBERNAZ, P. L. M. 1995. Doenças metabólicas da orelha interna. RBM. 2(1): São Paulo. 18-22.
POIAN, A. T.; CARVALHO-ALVES P. C. 2005. Hormônios e metabolism integração e correlações clínicas. São Paul Atheneu.
SHILS, M. E et al. 2003.Tratado de nutrição moderna na saúde e na doença. 9. ed. São Paul Manole.
SILVA, M. L. G et al. 2000. Labirintopatias de origem metabólica. In: SILVA M. L. G; MUNHOZ M. S. L; GANANÇA M. M; CAOVILLA, H. H. Quadros clínicos otoneurológicos mais comuns. 37-45. São Paul Atheneu.
Fonte: http://www.brasilclinicas.com.br/artigos/ler.aspx?artigoID=67
ORIENTAÇÕES NUTROLÓGICAS PARA LABIRINTOPATIAS
- Não permaneça mais de três horas sem se alimentar, sendo que deve-se evitar refeições apenas com carboidratos, portanto sempre acrescente algo que altere a carga glicêmica (gordura, proteína, fibras);
- Procure comer devagar e mastigar bem os alimentos;
- Coma frutas (com baixo índice glicêmico) e legumes e verduras pelo menos duas vezes ao dia;
- É recomendado a suspensão do consumo de álcool e cigarro;
- Beba no minimo 40ml/kg/dia de água:
- Faça atividades físicas e descubra a qual você se adapta mais, a prática de atividade física é crucial no tratamento, em especial musculação;
- Evite bebidas estimulantes como café, chá preto, chá verde e chocolates;
- Evite açúcares, trocando-o pelos adoçantes;
- Diminua o consumo de sal;
- Evite na medida do possível, de situações de estresse, aumentando o tempo de lazer;
- Substitua a fritura por alimentos assados;
- Consuma fontes de zinco, potássio, magnésio, complexo B e omega 3.
Ao longo dos anos, vêm-se observando que o tratamento dietético pode reduzir de forma acentuada, os sintomas da disfunção labiríntica. Com base nesta observação, buscamos revisar a literatura de forma a avaliar a relação entre o manejo dietético e o controle da função labiríntica. De forma geral, a literatura concorda com a nossa observação de que o tratamento dietético pode diminuir os sintomas da disfunção labiríntica, proporcionando o alívio para o paciente e melhorando a sua qualidade de vida.
As queixas vestibulares e auditivas têm, freqüentemente, sido associadas ao metabolismo anormal dos carboidratos e dos lipídios. Estima-se que a ocorrência dos distúrbios do metabolismo dos carboidratos, esteja entre 42% a 80% dos pacientes portadores de zumbidos e tonturas e, se percebe a nítida necessidade de demonstrar o impacto destes distúrbios sobre o funcionamento da orelha interna, pois nos parece evidente a melhora dos sintomas com a instituição da dieta.
LABIRINTOPATIA METABÓLICA
Diversas condições metabólicas afetam intensamente o funcionamento do ouvido interno. Estas são capazes de determinar o aparecimento de alterações labirínticas que, na maioria dos casos, são decorrentes de distúrbios no metabolismo de carboidratos (SILVA, 2000).
A condição metabólica mais freqüentemente relacionada à disfunção da orelha interna refere-se aos distúrbios na secreção da insulina, com ou sem hipoglicemia reativa concomitante.
As estruturas labirínticas apresentam atividade metabólica intensa, sendo altamente sensíveis aos níveis de oxigênio, glicose e ATP (Adenosina Trifosfato). O labirinto é particularmente sensível a pequenas variações nos níveis plasmáticos de glicose e insulina. Tanto a hipoglicemia quanto a presença de altos níveis de insulina interferem na atividade enzimática responsável pelo potencial endococlear (BITTAR, 2004).
Nas labirintopatias ou afecções vestibulococleares, os sintomas mais freqüentes, em pacientes com hiperinsulinemia, são a vertigem típica, associada a sintomas auditivos, como tinnitus, sensação de plenitude auricular, disacusia e cefaléia, limitando a qualidade de vida do indivíduo. É notável que os antecedentes pessoais e familiares dos portadores de labirintopatia metabólica revelam hábitos de alimentação inadequados, sedentarismo e tendência familiar para doenças como diabetes, hipertensão arterial e distúrbios hormonais (SILVA, 2000). De acordo com Ganança (1995), dois terços dos casos ocorrem em pessoas do sexo feminino, na faixa etária compreendida entre os 35 e 55 anos (80% dos casos), com tendência à obesidade , queixa de crises vertiginosas, já tendo sido submetidas a diversos especialistas, apresentando melhora parcial no início, porém sem resultado a longo prazo.
É evidente que, nos distúrbios metabólicos sistêmicos, o labirinto é atingido precocemente, sinalizando a necessidade de intervenção. Em relação à orientação terapêutica, o distúrbio deve ser diagnosticado e corrigido. Na maioria das vezes a correção requer orientação alimentar.
A HIPERINSULINEMIA COMO FATOR DESENCADEANTE DA LABIRINTOPATIA
Os carboidratos constituem a fonte mais importante de energia do organismo sendo que o principal carboidrato é a glicose (CINGOLANI, 2004). Os carboidratos são ingeridos com a dieta, principalmente na forma de polissacarídeos (amido) e dissacarídeos (sacarose e lactose). Após a sua digestão, os carboidratos passam para a circulação como monossacarídeos. Os monossacarídeos glicose, frutose e galactose são absorvidos, através da mucosa intestinal, e chegam até o fígado através da veia porta (CINGOLANI, 2004). O fígado libera glicose na corrente sangüínea, onde seu nível é mantido por ações dos hormônios. A elevação dos níveis séricos de glicose estimula insulina, que retira glicose da corrente sangüínea para as células (LIPPINCOTT, 2004).
Dentre os distúrbios do metabolismo do açúcar aceitos atualmente como responsáveis por alterações labirínticas, estão as disfunções metabólicas da glicose, incluindo diabetes, hipoglicemia reativa e hiperinsulinemia (BITTAR, 2004). A secreção de insulina, que é constante, pode ser modificada de acordo com estímulos específicos que podem aumentar ou diminuir sua taxa secretória (DOUGLAS, 2002). Além dos neurotransmissores e hormônios, os nutrientes constituem-se estímulo para a secreção insulínica. Os níveis aumentados de insulina resultam na redução da oferta de oxigênio para as células, o que induz prejuízo à função auditiva (BITTAR, 2003).
A insulina e, secundariamente, a glicose, seriam fundamentais na produção energética e ao adequado funcionamento da bomba de sódio e potássio. Ao nível celular e bioquímico isto se explica pela composição dos líquidos labirínticos: a endolinfa, é rica em potássio e pobre em sódio. A perilinfa, ao contrário, é rica em sódio e pobre em potássio (FERREIRA JÚNIOR, 2000). Como os líquidos são separados por uma membrana permeável, existe uma tendência às trocas dos líquidos gerando hipernatremia na endolinfa, deslocando água para este compartimento, provocando vertigem, zumbido, hipoacusia e plenitude auricular (FERREIRA JÚNIOR, 2000).
Com o adequado fornecimento de energia, obtida pela oxidação da glicose, o sódio retorna à perilinfa em troca de potássio, evitando as alterações clínicas citadas. Portanto, para manter o equilíbrio da bomba de sódio e potássio é necessário um aporte adequado de glicose e oxigênio, pois é através dessas duas substâncias que haverá a liberação de energia essencial para o funcionamento adequado do ouvido interno.
Do contrário, o aporte insuficiente de energia, gerado pela hiperinsulinemia, provoca a inativação da bomba de sódio e potássio o que, segundo Silva (2000), resulta também em queixas relativas à intolerância a sons, dificuldade de concentração, tendência à obesidade, irritabilidade, sonolência matinal e migrânea.
OS ALIMENTOS NO CONTROLE DA INSULINEMIA
Quando nos alimentamos, o processo de absorção dos nutrientes ocorre de forma gradual e contínua, aproximadamente 20 minutos após o início da refeição (POIAN, 2005). Após uma refeição, podem ser observados níveis plasmáticos de glicose alcançando o dobro dos níveis basais. Daí a importância de que a secreção de insulina ocorra também de forma gradual, acompanhando as oscilações dos níveis plasmáticos de glicose (POIAN, 2005).
O estímulo à secreção de insulina se dá por diversos fatores e qualquer desequilíbrio na concentração fisiológica de glicose plasmática pode determinar alterações e danos em vários tecidos/órgãos (POIAN, 2005).
O aumento na incidência de diabetes evidencia uma inabilidade gradual do pâncreas na produção de elevadas concentrações de insulina ao longo da vida.
Segundo Fukuda (2003), o consumo de sacarose tem sido exagerado nas últimas décadas e nosso organismo não teve o tempo necessário para adaptar-se às elevadas quantias ingeridas. O resultado dessa inadequação é a hiperinsulinemia com conseqüente hipoglicemia reativa e sintomas como cefaléia, sonolência, tonturas, etc (BITTAR, 2004).
A absorção de alimentos contendo carboidratos depende de sua complexidade estrutural, seu teor de fibras e sua apresentação. Isto resulta em graus variáveis de absorção da glicose neles contidos (COSTA, 2004). A intervenção nutricional nos distúrbios do metabolismo dos carboidratos, prevê o controle tanto do índice glicêmico dos alimentos utilizados na dieta quanto da carga glicêmica presente em cada refeição. O índice glicêmico de um alimento está relacionado ao impacto de sua composição na glicemia (alto, moderado ou baixo) após a sua ingestão. Já a carga glicêmica está relacionada ao impacto resultante do volume ingerido (alto, médio ou baixo). Um alimento que apresenta alto índice glicêmico, não necessariamente vai representar alta carga glicêmica na refeição, se a quantidade ingerida estiver sob controle. Na prática clínica, observa-se que, uma dieta com baixa carga glicêmica reduz os lipídios sangüíneos em indivíduos hipertrigliceridêmicos; reduz a secreção de insulina e melhora o controle global da glicemia em pacientes diabéticos insulino-dependentes e não insulino-dependentes.
O incremento de alimentos ricos em fibras solúveis e o adequado fracionamento das refeições, também buscam retardar a taxa de liberação de nutrientes no organismo, com repercussão positiva no controle dos distúrbios metabólicos. Quanto maior o teor de fibras do alimento e o retardo do esvaziamento do estômago, menor será a elevação da glicose no sangue após sua ingestão. Por outro lado, de acordo com Costa, 2004, a “pré-digestão” dos alimentos (amassar, triturar, esmagar, ralar e o excessivo cozimento) pode facilitar e aumentar a absorção da glicose. Neste caso, a alteração do índice glicêmico, é dependente dos outros alimentos ingeridos na mesma refeição e do modo de preparo dos mesmos.
Além do controle da quantidade, da qualidade, da freqüência e da combinação dos alimentos, é fundamental que sejam excluídos dos hábitos alimentares e de vida o consumo de álcool, da cafeína e o uso do tabaco, por conterem substâncias estimulantes da liberação da insulina.
Shils (2003) afirma que diferentes indivíduos podem ter respostas glicêmicas vastamente diferentes a um alimento, dependendo do seu estado de tolerância à glicose, idade e peso. Uma das mais eficazes opções terapêuticas parece ser a utilização de dietas nutricionais adequadas a cada caso, para que o tratamento seja dirigido à causa do distúrbio.
A PARTICIPAÇÃO DA DIETA NO CONTROLE DA LABIRINTOPATIA METABÓLICA
A dieta é a principal arma no combate aos sintomas causados por alterações do metabolismo da glicose ou da insulina. Está bem estabelecido que 90% dos pacientes submetidos a orientações dietéticas têm alívio ou cura dos sintomas (BITTAR, 1998 apud Mangabeira-Albernaz (1984).
Na prática clínica, observa-se que, durante o tratamento, os indivíduos com distúrbio labiríntico e alterações na curva insulinêmica, têm os sintomas reduzidos, em diferentes graus de intensidade. Entre três e seis meses de acompanhamento os mesmos desaparecem, quase em sua totalidade.
Nota-se, também, que os sintomas mais freqüentes e mais beneficiados com o uso da dieta são a cefaléia, a tontura, a sonolência e a plenitude auricular. Após a avaliação dos indivíduos, conclui-se que a maioria dos casos está relacionada a vícios nutricionais comuns.
Acredita-se que a intervenção nutricional precoce, em indivíduos que apresentam distúrbios da audição e do equilíbrio de origem metabólica, pode ser eficaz na redução ou mesmo no desaparecimento dos sintomas, contribuindo para o alívio do paciente e para uma melhor qualidade de vida. Um controle metabólico adequado pode retardar o aparecimento ou a progressão de complicações crônicas.
REFERÊNCIAS
BITTAR, R. S. M.; BOTTINO, M. A.; VENOSA, A. et al. 2004. Vestibular impairment secondary to glucose metabolic disorders: reality or myth? Revista Brasileira de Otorrinolaringologia, v.70, n.6, nov/dez. São Paulo. 801-6.
BITTAR, R. S. M.; BOTTINO, M. A.; ZERATI, F.E. et al. 2003. Prevalência das alterações metabólicas em pacientes portadores de queixas vestibulares. Revista Brasileira de Otorrinolaringologia. v.69, n.1 jan/fev. São Paulo.
BITTAR, R. S. M; SANCHEZ, T. G.; SANTORO, P.P et al. 1998. O metabolismo da glicose e o ouvido interno. Arquivos Internacionais de Otorrinolaringologia. V.2 Ed.1. São Paulo. 112-20.
CINGOLANI, G. C. 2004. Metabolismo dos carboidratos. In: CINGOLANI, H. E.; HOUSSAY, A. B. Fisiologia humana de Houssay. 7. ed. Porto Alegre: Artmed. 508-16.
COSTA, A. A; ALMEIDA NETO, J. S. 2004. Manual de diabetes: educação, alimentação, medicamentos, atividades físicas. 4. ed. São Paul Sarvier.
DOUGLAS, Carlos R. 2002. Tratado de fisiologia aplicada à nutrição. São Paul Robe Editorial.
LIPPINCOTT, W. & W. 2004. Nutriçã incrivelmente fácil. Rio de Janeir GUANABARA KOOGAN.
FERREIRA JÚNIOR, C. A.; GUIMARÃES, R. E. S.; BECKER, H. M. G et al. 2000. Avaliação metabólica do paciente com labirintopatia. Arquivos da Fundação Otorrinolaringologia, São Paulo, v.4, n.1 jan/fev/mar.
FUKUDA, Y. 2003. Otorrinolaringologia. Guias de medicina ambulatorial e hospitalar. São Paul Manole.
GANANÇA, M. M.; FUKUDA, Y. 1995. Labirintopatias vasculares e metabólicas. In: HUNGRIA H. Otorrinolaringologia. 7 ed. 393-401. Rio de Janeir GUANABARA KOOGAN. 393-401.
MANGABEIRA-ALBERNAZ, P. L. M. 1995. Doenças metabólicas da orelha interna. RBM. 2(1): São Paulo. 18-22.
POIAN, A. T.; CARVALHO-ALVES P. C. 2005. Hormônios e metabolism integração e correlações clínicas. São Paul Atheneu.
SHILS, M. E et al. 2003.Tratado de nutrição moderna na saúde e na doença. 9. ed. São Paul Manole.
SILVA, M. L. G et al. 2000. Labirintopatias de origem metabólica. In: SILVA M. L. G; MUNHOZ M. S. L; GANANÇA M. M; CAOVILLA, H. H. Quadros clínicos otoneurológicos mais comuns. 37-45. São Paul Atheneu.
Fonte: http://www.brasilclinicas.com.br/artigos/ler.aspx?artigoID=67
ORIENTAÇÕES NUTROLÓGICAS PARA LABIRINTOPATIAS
- Não permaneça mais de três horas sem se alimentar, sendo que deve-se evitar refeições apenas com carboidratos, portanto sempre acrescente algo que altere a carga glicêmica (gordura, proteína, fibras);
- Procure comer devagar e mastigar bem os alimentos;
- Coma frutas (com baixo índice glicêmico) e legumes e verduras pelo menos duas vezes ao dia;
- É recomendado a suspensão do consumo de álcool e cigarro;
- Beba no minimo 40ml/kg/dia de água:
- Faça atividades físicas e descubra a qual você se adapta mais, a prática de atividade física é crucial no tratamento, em especial musculação;
- Evite bebidas estimulantes como café, chá preto, chá verde e chocolates;
- Evite açúcares, trocando-o pelos adoçantes;
- Diminua o consumo de sal;
- Evite na medida do possível, de situações de estresse, aumentando o tempo de lazer;
- Substitua a fritura por alimentos assados;
- Consuma fontes de zinco, potássio, magnésio, complexo B e omega 3.
Postado por
Dr. Frederico Lobo
às
10:50
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

segunda-feira, 26 de setembro de 2011
Dieta deficiente
A renda familiar e a escolaridade dos pais são fatores que influenciam na dieta dos adolescentes, restringindo a ingestão de nutrientes importantes no combate de doenças crônicas, como hipertensão e diabetes.
A conclusão é de uma pesquisa realizada na capital paulista pela Faculdade de Saúde Pública da Universidade de São Paulo (FSP-USP), em parceria com a Secretaria Municipal de Saúde de São Paulo, e publicada na revista Public Health Nutrition.
O estudo foi tema do mestrado de Eliseu Verly Júnior, com coordenação de Dirce Maria Lobo Marchioni e participação de Regina Mara Fisberg, ambas professoras do Departamento de Nutrição da FSP-USP.
Com o objetivo de avaliar o consumo alimentar de 525 adolescentes, com idade entre 14 e 18 anos, o trabalho integrou o Inquérito de Saúde no Município de São Paulo (ISA), que visa conhecer com mais detalhes o perfil epidemiológico da população da cidade.
O nutriente com maior percentual de ingestão inadequada nessa faixa etária foi a vitamina E, apresentando deficiência de 99% na dieta de ambos os sexos. Em segundo lugar esteve o magnésio, com 89% de inadequação entre os adolescentes do sexo masculino e 84% do feminino, seguido pelas vitaminas A (78% e 71%), C (79% e 53%) e B6 (21% e 33%).
“Existem diversas variáveis que determinam o baixo consumo desses nutrientes nessa faixa etária como, por exemplo, a renda familiar per capita. As pessoas que pertencem ao grupo de baixa renda apresentaram menor consumo de nutrientes, entre os quais as vitaminas A, C, B6, B12, fósforo, zinco, tiamina e riboflavina”, disse Verly.
“Isso ocorre porque as pessoas dessa faixa etária geralmente consomem baixas quantidades de frutas, verduras e legumes, que são importantes fontes de nutrientes”, disse Verly, que atualmente faz doutorado na FSP-USP. "A condição financeira restringe o acesso aos alimentos e, dessa forma, a uma dieta mais adequada. Isso indica que a camada menos favorecida tem pior condição nutricional”, apontou Fisberg.
O estudo verificou ainda que a deficiência na dieta também esteve relacionada ao nível escolar dos pais. Os dados mostraram que a menor escolaridade foi associada às maiores prevalências de inadequação de consumo dos mesmos nutrientes apontados em jovens de baixa renda. Para Fisberg, os dados apresentados pela pesquisa podem auxiliar futuros programas de estímulo ao consumo de alimentos fontes dos nutrientes deficientes – presentes em frutas, vegetais e cereais, entre outros –, voltados à população de baixa renda.
Fonte: http://www.hebron.com.br/
A conclusão é de uma pesquisa realizada na capital paulista pela Faculdade de Saúde Pública da Universidade de São Paulo (FSP-USP), em parceria com a Secretaria Municipal de Saúde de São Paulo, e publicada na revista Public Health Nutrition.
O estudo foi tema do mestrado de Eliseu Verly Júnior, com coordenação de Dirce Maria Lobo Marchioni e participação de Regina Mara Fisberg, ambas professoras do Departamento de Nutrição da FSP-USP.
Com o objetivo de avaliar o consumo alimentar de 525 adolescentes, com idade entre 14 e 18 anos, o trabalho integrou o Inquérito de Saúde no Município de São Paulo (ISA), que visa conhecer com mais detalhes o perfil epidemiológico da população da cidade.
O nutriente com maior percentual de ingestão inadequada nessa faixa etária foi a vitamina E, apresentando deficiência de 99% na dieta de ambos os sexos. Em segundo lugar esteve o magnésio, com 89% de inadequação entre os adolescentes do sexo masculino e 84% do feminino, seguido pelas vitaminas A (78% e 71%), C (79% e 53%) e B6 (21% e 33%).
“Existem diversas variáveis que determinam o baixo consumo desses nutrientes nessa faixa etária como, por exemplo, a renda familiar per capita. As pessoas que pertencem ao grupo de baixa renda apresentaram menor consumo de nutrientes, entre os quais as vitaminas A, C, B6, B12, fósforo, zinco, tiamina e riboflavina”, disse Verly.
“Isso ocorre porque as pessoas dessa faixa etária geralmente consomem baixas quantidades de frutas, verduras e legumes, que são importantes fontes de nutrientes”, disse Verly, que atualmente faz doutorado na FSP-USP. "A condição financeira restringe o acesso aos alimentos e, dessa forma, a uma dieta mais adequada. Isso indica que a camada menos favorecida tem pior condição nutricional”, apontou Fisberg.
O estudo verificou ainda que a deficiência na dieta também esteve relacionada ao nível escolar dos pais. Os dados mostraram que a menor escolaridade foi associada às maiores prevalências de inadequação de consumo dos mesmos nutrientes apontados em jovens de baixa renda. Para Fisberg, os dados apresentados pela pesquisa podem auxiliar futuros programas de estímulo ao consumo de alimentos fontes dos nutrientes deficientes – presentes em frutas, vegetais e cereais, entre outros –, voltados à população de baixa renda.
Fonte: http://www.hebron.com.br/
Postado por
Dr. Frederico Lobo
às
21:14
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook

quinta-feira, 9 de setembro de 2021
Manejo da osteoporose em mulheres na pós-menopausa: a declaração de posição de 2021 da Sociedade Norte-Americana da Menopausa
Texto para médicos.
Objetivo: Rever as evidências sobre triagem, prevenção, diagnóstico e manejo da osteoporose na última década e atualizar a declaração de posição publicada pela Sociedade Norte-Americana da Menopausa (NAMS) em 2010 sobre o manejo da osteoporose em mulheres na pós-menopausa à medida que novas terapias e paradigmas se tornaram disponíveis.
Design: O NAMS contratou um painel de especialistas clínicos na área de doenças ósseas metabólicas e/ou saúde da mulher para revisar e atualizar a declaração e recomendações de posição do NAMS de 2010 com base em novas evidências e julgamento clínico. As recomendações do painel foram revisadas e aprovadas pelo Conselho de Curadores do NAMS.
Resultados: A osteoporose, especialmente prevalente em mulheres mais velhas na pós-menopausa, aumenta o risco de fraturas que podem estar associadas a morbidade e mortalidade significativas. A perda óssea pós-menopausa, relacionada à deficiência de estrogênio, é o principal contribuinte para a osteoporose. Outros fatores de risco importantes para osteoporose pós-menopausa incluem idade avançada, genética, tabagismo, magreza e muitas doenças e drogas que prejudicam a saúde óssea. Uma avaliação desses fatores de risco para identificar candidatos à triagem de osteoporose e recomendar medidas não farmacológicas, como boa nutrição (especialmente ingestão adequada de proteínas, cálcio e vitamina D), atividade física regular e evitar tabagismo e consumo excessivo de álcool, são apropriadas para todas as mulheres na pós-menopausa. Para mulheres com alto risco de osteoporose, especialmente mulheres na perimenopausa com baixa densidade óssea e outros fatores de risco, estrogênio ou outras terapias estão disponíveis para prevenir a perda óssea. Para mulheres com osteoporose e/ou outros fatores de risco para fraturas, incluindo idade avançada e fraturas anteriores, o principal objetivo da terapia é prevenir novas fraturas. Isso é conseguido combinando medidas não farmacológicas, drogas para aumentar a densidade óssea e melhorar a força óssea e estratégias para reduzir o risco de quedas. Se a terapia farmacológica estiver indicada, as opções aprovadas pelo governo incluem agonistas/antagonistas de estrogênio, bifosfonatos, inibidores do ligante RANK, agonistas do receptor do hormônio da paratireóide e inibidores da esclerostina.
Conclusões: A osteoporose é um distúrbio comum em mulheres na pós-menopausa. O gerenciamento da saúde esquelética em mulheres na pós-menopausa envolve avaliar fatores de risco para fraturas, reduzir fatores de risco modificáveis por meio de mudanças na dieta e no estilo de vida e o uso de terapia farmacológica para pacientes com risco significativo de osteoporose ou fratura. Para mulheres com osteoporose, o manejo ao longo da vida é necessário. As decisões de tratamento ocorrem continuamente ao longo da vida de uma mulher na pós-menopausa. As decisões devem ser individualizadas e devem incluir o paciente no processo de tomada de decisão compartilhada.
INTRODUÇÃO
A osteoporose pode ser uma séria ameaça à saúde das mulheres na pós-menopausa, predispondo-as a fraturas que podem estar associadas a morbidade e mortalidade substanciais, especialmente em mulheres mais velhas. O manejo clínico não pode ser definido ou confinado apenas por “evidências”. Não existe uma estratégia de manejo única ou ideal para um distúrbio crônico, como a osteoporose. Quando faltam evidências, os médicos usam o julgamento clínico, consistindo em decisões de manejo individualizadas para cada paciente e para diferentes estágios do curso da doença e com base em uma combinação de evidências conhecidas, conhecimento da fisiologia do problema que está sendo abordado e sua experiência.
A Sociedade Norte-Americana da Menopausa (NAMS) cria declarações de posição sobre distúrbios específicos para fornecer informações confiáveis e precisas sobre o manejo de condições de saúde associadas à menopausa. Aqui, o NAMS fornece orientações sobre o diagnóstico, avaliação, prevenção e tratamento da osteoporose em mulheres na pós-menopausa na América do Norte.
As recomendações aqui contidas baseiam-se, sempre que possível, em evidências fornecidas por ensaios clínicos e, onde não existem evidências, na melhor prática clínica atual nas opiniões e julgamento clínico de um painel editorial composto por clínicos e pesquisadores com experiência em doenças ósseas metabólicas ou saúde da mulher. Essas declarações não representam diretrizes ou padrões de práticas codificadas, conforme definido por órgãos reguladores e agências de seguros. Em vez disso, o painel editorial tentou fornecer informações suficientes para que os médicos abordassem mulheres na pós-menopausa com ou em risco de osteoporose com uma compreensão confiante das opções de gerenciamento. As recomendações estão focadas nas percepções das necessidades dos profissionais de saúde que cuidam da saúde esquelética das mulheres na pós-menopausa no ambiente da atenção primária. As orientações aqui fornecidas são geralmente consistentes com as recomendações para a avaliação e tratamento da osteoporose pós-menopausa disponíveis em várias outras sociedades e organizações norte-americanas.
Esta declaração de posição é uma atualização da declaração de posição de 2010, “Gerenciamento da Osteoporose em Mulheres na Pós-menopausa”. Desde então, vários novos medicamentos com mecanismos sofisticados de ação receberam aprovação do governo com base em dados de ensaios clínicos randomizados e controlados (ECR). Além disso, novos conhecimentos sobre a fisiopatologia e epidemiologia da osteoporose pós-menopausa tornaram-se disponíveis, assim como novas perspectivas sobre o papel da hormonioterapia (HT) no manejo da saúde esquelética, maior experiência com a eficácia e segurança de medicamentos osteoporose mais antigos, o papel potencial dos feriados medicamentosos para bifosfonatos e novos paradigmas em relação ao uso sequencial e terapias de osteoporose anabólica e anti-remodelação. Esses avanços criaram a necessidade de atualizar a declaração de posição.
AVALIANDO PACIENTES PARA E COM OSTEOPOROSE
Histórico: A osteoporose - o distúrbio ósseo mais comum que afeta humanos - é um distúrbio esquelético generalizado caracterizado por comprometimento da força óssea, predispondo uma pessoa a um risco aumentado de fratura, principalmente da coluna vertebral e do quadril. Essas e outras fraturas graves ocorrem mais comumente em mulheres mais velhas na pós-menopausa e muitas vezes são eventos que alteram a vida. No entanto, a perda óssea que resulta em osteoporose é mais acentuada durante a transição da menopausa e a menopausa precoce. Fraturas menos graves, como fraturas de punho, ocorrem em mulheres jovens na pós-menopausa e são importantes sinais de alerta de osteoporose.
Pessoas com osteoporose e alto risco de fratura podem ser prontamente identificadas. Estratégias gerais e farmacológicas de manejo estão disponíveis para retardar ou prevenir a perda óssea e reduzir o risco de fratura. Como a osteoporose é um distúrbio tão comum, a avaliação da saúde esquelética deve fazer parte da avaliação de rotina de todas as mulheres na pós-menopausa, e todos os profissionais que cuidam de mulheres na pós-menopausa devem ser competentes e confiantes em realizar essa avaliação.
• Fisiopatologia: Em adultos, o tecido ósseo sofre mudanças constantes por um processo chamado remodelação óssea. O material ósseo antigo (matriz mineral e proteica) é reabsorvido (removido) por osteoclastos e substituído por novos ossos saudáveis por osteoblastos. Osteócitos se interconectam na matriz sólida do osso através de uma extensa rede canalicular que detecta tanto o carregamento mecânico quanto o dano ósseo focal. Osteócitos secretam moléculas que regulam tanto a localização quanto a taxa de remodelação óssea. Estes incluem o ativador do receptor do ligante kappa-β (RANK), um fator promotor de crescimento cuja interação com seu receptor RANK é necessária para a proliferação, diferenciação e atividade dos osteoclastos; e esclerostina, um inibidor da formação óssea. A atividade dos osteocócitos é, por sua vez, regulada por carga mecânica e hormônios circulantes, incluindo hormônio paratireoidiano (PTH) e estrogênio.
A força óssea (e, portanto, o risco de fratura) depende de muitas qualidades ósseas, das quais a densidade mineral óssea (DMO) é a mais comumente medida. A densidade óssea em qualquer idade é uma função do pico de massa óssea (atingida aos 30 anos) e da quantidade de osso é posteriormente perdido. Em mulheres saudáveis na pré-menopausa, a massa óssea é bastante estável. A quantidade de osso antigo reabsorvido é substituída por uma quantidade quase igual de osso novo. Durante a perimenopausa, a deficiência de estrogênio resulta em aumento da expressão do ligante RANK, ativando osteoclastos. A reabsorção óssea se torna mais rápida, superando a capacidade dos osteoblastos de formar novos ossos, resultando em uma fase acelerada de perda óssea durante a transição da menopausa.
A taxa média anual de perda óssea é de cerca de 2%, começando 1 a 3 anos antes da menopausa e durando de 5 a 10 anos, resultando em uma perda média de DMO de 10% a 12% na coluna vertebral e quadril durante a transição da menopausa. As taxas de perda são um pouco maiores em mulheres magras versus pesadas. Após esse intervalo de perda óssea relativamente rápida, a densidade óssea diminui cerca de 0,5% ao ano. Esse desequilíbrio no remodelamento continua até a idade avançada, na qual um déficit adicional na função osteoblástica limita a formação óssea. Aos 80 anos, as mulheres perderam, em média, aproximadamente 30% do seu pico de massa óssea.
A perda óssea após a menopausa resulta em uma deterioração gradual, mas progressiva, da microarquitetura do osso trabecular e cortical, enfraquecendo o esqueleto e aumentando o risco de fratura. As trabéculas espessas e numerosas vistas na coluna vertebral e nas extremidades dos ossos longos em mulheres na pré-menopausa ficam afinadas e perfuradas e podem ser completamente reabsorvidas, resultando em espaços vazios onde o tecido ósseo já existiu. A espessa casca externa do osso cortical é diluída por dentro e se torna mais porosa por causa da dominância da reabsorção óssea sobre a formação. Esse desequilíbrio na remodelação óssea pode ser acentuado por um estilo de vida muito sedentário, contribuindo para a perda óssea acelerada em mulheres inativas mais velhas. Muitas doenças e medicamentos podem amplificar esses efeitos aumentando a reabsorção óssea ou inibindo a formação óssea.
Outros fatores, incluindo mineralização óssea, composição da matriz, microestrutura e microdanos, bem como fatores relacionados à idade, como o acúmulo de produtos finais de glicação avançada, afetam a qualidade e a integridade do tecido ósseo. Esses fatores não podem ser medidos diretamente na prática clínica. Essas alterações combinadas na massa, estrutura e qualidade óssea resultam em comprometimento da força óssea e aumento do risco de fratura da osteoporose pós-menopausa.
• Densidade mineral óssea
A medição da densidade óssea areal (a quantidade de mineral ósseo dividida pela área do osso escaneado) por absorciometria de raios X de dupla energia (DXA), é a principal ferramenta clínica usada para avaliar a saúde esquelética. É necessária uma atenção à qualidade da aquisição e interpretação dos testes de densidade óssea DXA.
Para padronizar os valores de densidade óssea de diferentes locais esqueléticos, os resultados são relatados como escores T ou escores Z:
• O escore T compara a densidade óssea de uma mulher ao valor médio de mulheres jovens saudáveis e é expresso em unidades de desvio padrão (DP). Um escore T de +1 representa um valor 1 DP acima da média normal jovem, enquanto um valor 2,5 DPs abaixo da média normal jovem equivaleria a um escore T de -2,5. Por convenção, o valor branco (não ajustado à raça), jovem e normal serve como referência para escores T em mulheres de todas as raças.
• O escore Z é o número de DSs acima ou abaixo da densidade óssea média para a pessoa média da mesma idade, sexo e etnia. A faixa normal para o escore Z é de -2,0 a +2,0. O escore Z tem valor limitado em mulheres na pós-menopausa.
Estudos até o momento fornecem dados inadequados sobre iniquidades raciais nos cuidados de saúde. Questões individuais e de nível de sistema que promovem a desigualdade precisam ser abordadas em novas pesquisas.
• Diagnosticando osteoporose
A categorização diagnóstica por densidade óssea é baseada nas recomendações de um Grupo de Estudos da Organização Mundial da Saúde (Tabela 1).
Na América do Norte, o critério padrão para o diagnóstico de osteoporose em mulheres na pós-menopausa é um escore T de -2,5 ou menos na coluna lombar (LS; pelo menos dois níveis vertebrais medidos na projeção póstero-anterior, se fatores anatômicos como artrite ou substituição do quadril invalidarem as medições da coluna vertebral e do quadril, a densidade óssea do terço distal do rádio (antebraço) pode ser considerada um local de diagnóstico, mas outros métodos de diagnóstico da osteoporose e avaliação do risco de fratura também devem ser considerados. Quando o escore T de uma mulher aumenta com o tratamento de menos de -2,5 para valores acima de -2,5, o diagnóstico de osteoporose persiste.
O diagnóstico de baixa DMO, ou osteopenia, não indica necessariamente que ocorreu perda óssea. Este termo tem uso clínico limitado porque inclui mulheres jovens na pós-menopausa sem outros fatores de risco que estão em baixo risco de fratura, bem como mulheres mais velhas com outros fatores de risco que estão em risco muito alto de fratura.
Os escores T podem ser gerados a partir de outros métodos de avaliação da DMO, e algumas dessas medições demonstraram prever o risco de fratura. Em geral, no entanto, os escores T desses outros métodos não devem ser usados para diagnosticar osteoporose.
Além da DMO, o diagnóstico clínico de osteoporose pode ser feito em mulheres na pós-menopausa que apresentam fraturas da coluna ou quadril ou que têm outros fatores de risco, resultando em alto risco de fratura (Tabela 2)
A osteoporose é categorizada como primária ou secundária. A osteoporose primária refere-se à perda óssea que ocorre após a menopausa e com o envelhecimento. A osteoporose secundária é diagnosticada quando medicamentos como glicocorticóides ou doenças contribuem para a perda óssea.
• Prevalência
No National Health and Nutrition Examination Survey 2013-2014, 16,5% das mulheres americanas com 50 anos ou mais tiveram osteoporose, definida como um escore T de DMO de -2,5 ou menos no FN ou LS.
Prevalência semelhante foi observada no Canadá e no México. A prevalência de osteoporose por baixa DMO do NF aumenta com a idade, de 6,8% em mulheres de 50 a 59 anos para 34,9% em mulheres com 80 anos ou mais.
Nos Estados Unidos, as taxas de osteoporose variam de acordo com a etnia: os negros americanos têm a maior DMO, enquanto os asiático-americanos têm a menor.
Essas diferenças, no entanto, podem estar mais relacionado ao peso corporal do que à raça.
Mais de 2 milhões de fraturas relacionadas à osteoporose ocorrem a cada ano nos Estados Unidos, incluindo mais de 700.000 fraturas vertebrais clínicas e 300.000 fraturas de quadril, resultando em mais de 500.000 internações hospitalares.
A maioria dessas fraturas ocorre em mulheres mais velhas na pós-menopausa, com dois terços das fraturas ocorrendo após os 75 anos de idade, para uma mulher branca americana de 50 anos, o risco de sofrer uma fratura osteoporótica em sua vida restante foi estimado em 40%, e para fraturas vertebrais sintomáticas de quadril, antebraço e sintomáticas estão em 17,5%, 16,0% e 15,6%, respectivamente.
Os riscos de vida para fraturas de quadril são de 17% para brancos americanos, 14% para hispano-americanos e 6% para negros americanos.
As taxas ajustadas por idade de fratura de quadril em mulheres nos Estados Unidos e no Canadá pareciam estar diminuindo após 1997. No entanto, dados recentes sugerem que essas taxas estagnaram e podem até estar aumentando novamente, talvez relacionadas ao declínio do uso de medicamentos para osteoporose desde 2008.
O número absoluto de pacientes com fraturas continuará a aumentar devido ao crescimento populacional.
• Morbidade e mortalidade
As fraturas de quadril, que ocorrem em média aos 82 anos, provocam um custo particularmente devastador, resultando em maior custo e incapacidade do que todos os outros tipos de fratura combinados.
As fraturas do quadril causam um aumento de até 25% na mortalidade dentro de 1 ano após o incidente.
Até 25% das mulheres precisam de cuidados de longo prazo após uma fratura de quadril, e 50% terá alguma perda de mobilidade a longo prazo.
A incidência anual de sofrer uma segunda fratura de quadril é de 2% a 10%, com a segunda fratura ocorrendo, em média, cerca de 2 anos após a primeira.
Fraturas em outros locais, incluindo coluna vertebral, úmero e pelve, também podem resultar em morbidade grave.
Fraturas vertebrais múltiplas ou graves podem causar dor substancial, bem como perda de altura e curvatura exagerada da coluna torácica (cifose), movimento restrito e função pulmonar prejudicada.
Apenas cerca de um terço das fraturas vertebrais que podem ser diagnosticadas radiograficamente chegam à atenção clínica.
As fraturas vertebrais existentes aumentam o risco de fratura vertebral subsequente em cinco a sete vezes.
O risco relativo de mortalidade após a fratura vertebral é tão alto quanto com a fratura de quadril.
Dor pós-fratura, perda de mobilidade, alteração da imagem corporal e perda de independência pode ter fortes efeitos na autoestima e no humor.
Avaliação clínica
A avaliação da saúde esquelética, incluindo a avaliação de fatores de risco para baixa DMO e fratura, deve ser realizada em todas as mulheres na pós-menopausa. Essas informações podem identificar mulheres para testes de DMO e moldar recomendações para o manejo clínico.
• Fatores de risco e avaliação de risco
É importante distinguir entre fatores de risco para osteoporose, conforme definido pela DMO, e fatores de risco para fratura.
Os principais fatores de risco para baixa DMO em mulheres na pós-menopausa incluem status da menopausa, idade avançada, genética, magreza e doenças ou medicamentos com efeitos esqueléticos adversos.
Baixa DMO, bem como histórico de fratura prévia, idade avançada, história parental de fratura de quadril, fragilidade e outros problemas médicos são importantes fatores de risco para fratura.
Estão disponíveis ferramentas para avaliar o risco de baixa DMO e fratura osteoporótica.
• Fatores de risco para baixa densidade óssea.
• Idade avançada. A perda óssea diminui progressivamente com o avançar da idade, e a prevalência de osteoporose aumenta à medida que as mulheres envelhecem.
• Magreza. A densidade óssea em mulheres saudáveis está fortemente correlacionada com o peso corporal. Ser magro - muitas vezes citado como peso corporal inferior a 57,7 kg, o quartil de peso mais baixo para mulheres dos EUA com mais de 65 anos ou índice de massa corporal (IMC) inferior a 21 kg/m2 - é um fator de risco para baixa DMO.
• Genética. Estudos familiares demonstram que 50% a 85% da variância na DMO é geneticamente determinada. Muitos genes têm sido fracamente associados à baixa massa óssea em humanos.
• Fumar. As mulheres que fumam atualmente têm menor DMO do que os não fumantes. Os fumantes geralmente são mais magros e têm menopausa mais precoce e níveis séricos mais baixos de estradiol do que os não fumantes.
• Doenças e drogas. Muitas doenças e medicamentos afetam negativamente o esqueleto (Tabela 3).
Estes incluem distúrbios alimentares, doenças inflamatórias crônicas (ou seja, artrite reumatoide), doenças que causam má absorção (ou seja, doença celíaca) e várias endocrinopatias (hiperparatireoidismo, síndrome de Cushing). As drogas podem causar perda óssea aumentando a reabsorção óssea (inibidores da aromatase [IAs]), prejudicando o metabolismo da vitamina D (fenitoína) ou reduzindo a formação óssea (glicocorticóides), assim como cirurgias como bypass gástrico.
Fatores notáveis não preditivos de baixa DMO incluem ingestão diária ou ao longo da vida de cálcio ou vitamina D, ingestão de álcool ou cafeína, atividade física atual ou passada e história reprodutiva.
• Ferramentas para prever baixa densidade mineral óssea em mulheres na pós-menopausa.
Várias ferramentas simples estão disponíveis para identificar mulheres na pós-menopausa com probabilidade de ter baixa DMO. A Ferramenta de Autoavaliação da Osteoporose combina idade e peso corporal nesta fórmula: Ferramenta de Autoavaliação da Osteoporose T-score = 0,2 × (peso em kg menos idade em anos), truncado para produzir inteiro.
Usando uma definição de menos de 2 como alto risco, o desempenho da Ferramenta de Autoavaliação da Osteopor O Instrumento de Avaliação de Risco de Osteoporose demonstrou sensibilidade de 93,3% e 94,4% para selecionar mulheres canadenses com baixa DMO e osteoporose, respectivamente. Esses instrumentos são mais úteis para selecionar mulheres jovens na pós-menopausa para o teste de DMO.
• Fatores de risco para fratura.
Os fatores de risco mais importantes para fraturas em mulheres na pós-menopausa são história de fraturas ou quedas anteriores, idade avançada e baixa DMO. A combinação desses e de outros fatores de risco independentes melhora a capacidade de identificar pacientes com alto risco de fratura. Várias ferramentas de avaliação de risco de fratura estão disponíveis para estimar o risco de fratura de uma pessoa, incluindo a calculadora da Associação Canadense de Radiologistas e Osteoporose do Canadá. Este algoritmo baseado em computador está disponível on-line (www.sheffield.ac.uk/FRAX/) e em software DXA comum. Além de idade, sexo e IMC, o FRAX combina idade, sexo, IMC e fatores de risco independentes com base em metanálises de grandes coortes observacionais (Tabela 4).
Bancos de dados separados são usados para estimar o risco de fratura em mulheres brancas, negras, asiáticas e hispânicas nos Estados Unidos. Detalhes do uso da ferramenta FRAX, incluindo seus pontos fortes e limitações, foram revisados em outro lugar.
• Fratura prévia. Ter ou ter tido uma fratura desde a menopausa é o fator de risco mais importante e poderoso para ter outra fratura. O risco de refratura é especialmente alto (até 19% dentro de 12 meses) em pacientes com fraturas recentes.
Isso levou algumas organizações a descrever pacientes com uma fratura osteoporótica recente como tendo um risco muito alto ou iminente de fratura.
– No passado, termos como fragilidade ou fraturas não traumáticas eram usados para definir fraturas relacionadas à osteoporose e que previam fraturas futuras.
– Evidências recentes sugerem que todas as fraturas, exceto as da face, crânio, mãos e pés, estão associadas a baixa DMO e risco de fratura futura, independentemente da associação com trauma.
• Baixa densidade óssea. A correlação mais forte entre DMO e risco de fratura é com a densidade óssea do quadril. O risco de fratura de quadril aumenta 2,6 vezes para cada DP ajustado à idade (uma unidade de escore Z) na DMO do NF. A magnitude do risco associado à baixa DMO é modulada pela idade e outros fatores de risco.
• Idade. Para qualquer valor de DMO, as mulheres mais velhas têm maior risco de fratura do que as mulheres mais jovens na pós-menopausa.
• História parental de fratura de quadril. O componente mais forte de uma história familiar para prever o risco de fratura é a história parental de fratura de quadril.
• Fumar. O risco de fratura em mulheres na pós-menopausa que fumam está aumentado em cerca de 30%, independentemente da DMO.
• Consumo excessivo de álcool.
Consumir mais de três porções de álcool por dia está associado a um risco aumentado de 38% e 68% de fratura osteoporótica e de quadril maior, respectivamente.
Os fatores de risco não incorporados ao FRAX incluem aqueles que não estão disponíveis nos bancos de dados nos quais o FRAX foi baseado (por exemplo, quedas) ou não eram conhecidos quando o FRAX foi desenvolvido (diabetes):
• Quedas. A maioria das fraturas, incluindo muitas fraturas vertebrais, ocorre após uma queda de uma altura em pé ou menos.
Como resultado, fatores de risco para quedas, incluindo histórico de quedas recentes; fraqueza; equilíbrio, coordenação, visão ou audição prejudicados; obesidade; e artrite, também são fatores de risco para fraturas.
• Doenças e drogas. A saúde precária é um fator de risco para fraturas; a maioria das doenças está associada a um aumento geral no risco de fraturas (Tabela 3).
Doenças e medicamentos como diabetes tipo 2, obesidade e inibidores da bomba de prótons estão associados ao aumento do risco de fratura sem causar perda óssea.
• Distúrbios e drogas que afetam a força e o equilíbrio muscular, como fragilidade, acidente vascular cerebral e medicamentos antidepressivos, aumentam os riscos de quedas e fraturas.
Outros fatores de risco conhecidos para fratura incluem demência, baixa atividade física, cifose torácica, taxas de perda óssea e perda de peso e altura.
• Outros métodos de avaliação de risco.
A densidade óssea pode ser avaliada por outras técnicas além do DXA, incluindo ultrassom e tomografia computadorizada (TC) quantitativa. Os valores de escore T obtidos com essas técnicas não substituem os escores T do quadril ou da coluna obtidos com DXA, pois podem superestimar ou subestimar a DMO e, portanto, o risco de fratura.
Para aqueles poucos pacientes que não podem ter medições de DXA no quadril ou coluna vertebral, avaliar o risco de fratura com FRAX sem DMO fornece informações mais úteis do que a DMO medida por técnicas alternativas.
A TC biomecânica analisa tomografias computadorizadas quantitativas da SL e do quadril com um algoritmo chamado análise de elementos finitos que fornece estimativas validadas da força óssea em pacientes individuais.
A TC biomecânica prediz o risco de fratura, embora sua vantagem sobre a DXA seja pequena. O acesso à TC biomecânica é limitado e seu papel na prática clínica de rotina não foi definido.
O escore ósseo trabecular é um software especial disponível para máquinas DXA que analisa a heterogeneidade da distribuição de densidade em imagens LS DXA de rotina. As medições do escore ósseo trabecular se correlacionam com a microarquitetura trabecular e predizem o risco de fratura independentemente da densidade óssea.
O escore ósseo trabecular foi recentemente incorporado ao FRAX.
O uso do escore ósseo trabecular é mais útil em mulheres cujo risco de fratura está próximo do limiar de tratamento.
Avaliar o risco de quedas, com ênfase especial em um histórico de uma queda recente, é uma parte importante da avaliação de risco em mulheres idosas. A iniciativa Stopping Elderly Accidents Deaths and Injury desenvolvida pelo Centers for Disease Control and Prevention fornece um algoritmo para triagem de risco de queda.
• Limitações à avaliação do risco de fratura.
Existem limitações ao uso de qualquer um dos instrumentos individuais de avaliação de risco de fratura e do instrumento de avaliação de FRAX.
O FRAX subestima o risco de fratura em pacientes com quedas ou diabetes e naqueles com DMO de coluna baixa, mas não FN. Além disso, o escore atual do FRAX não permite a entrada para quantificação de fatores de risco, incluindo dose de glicocorticóide, quantidade de ingestão de álcool, duração e quantidade de tabagismo, ou número, tipo ou re prever a DMO, mas não foi para isso que foi projetado. Até que existam métodos práticos e baratos para medir a força óssea com precisão, estimar o risco de fratura com FRAX continuará sendo uma das ferramentas mais úteis.
• Indicações para testes de densidade óssea
A densidade óssea deve ser medida em mulheres na pós-menopausa com fatores de risco para baixa densidade óssea, onde conhecer o resultado influenciará o manejo clínico:
• Aquelas com histórico de fratura desde a menopausa
• Aquelas com causas médicas conhecidas de perda ou fratura óssea
• Aquelas com 65 anos ou mais
• Aquelas com 50 anos ou mais com um ou mais desses fatores de risco adicionais:
– Peso corporal inferior a 57,7 kg 127 lb) ou IMC inferior a 21 kg/m2
– História de fratura de quadril em um dos pais
– Fumante atual
– Descontinuando o estrogênio com fatores de risco adicionais para fratura
Em mulheres saudáveis na pós-menopausa sem osteoporose, o teste repetido de DMO após 3 anos não aumenta a previsão de risco de fratura.
Para mulheres na pós-menopausa com idade entre 50 e 64 anos com escores T basais maiores que -1,5, o reteste pode ser adiado para os 65 anos, a idade em que o rastreamento rotineiro da DMO é recomendado para todas as mulheres.
O reteste anterior deve ser considerado em mulheres dentro de 5 anos da menopausa cujo escore T inicial de DMO foi menor que -1,5 ou naquelas com outros fatores de risco importantes, como fratura prévia ou com problemas médicos ou medicamentos predisponentes à perda óssea.
• Exame físico
Os objetivos da avaliação de mulheres na pós-menopausa com osteoporose ou fatores de risco importantes são identificar fatores de risco modificáveis e causas secundárias de perda óssea, quantificar o risco de fratura e a gravidade da osteoporose e determinar candidatos apropriados à terapia farmacológica. Esta avaliação requer um histórico detalhado dos fatores de risco para fraturas e quedas, outras doenças e medicamentos, fraturas anteriores e histórico familiar. Um exame físico completo deve incluir avaliação de cifose, força muscular e equilíbrio. A altura em pé deve ser medida anualmente com um método preciso, como uma régua montada na parede ou um estadiômetro. Perda de altura de 3,8 cm ou mais aumenta a probabilidade de que uma fratura vertebral esteja presente. Isso requer avaliação por radiografia toracolombar lateral ou avaliação de fratura vertebral por DXA para identificar fraturas vertebrais por compressão assintomática.
O peso deve ser registrado para identificar aquelas mulheres com baixo IMC e estar ciente das mudanças de peso, o que pode interferir na interpretação das alterações na DMO ao longo do tempo. Para mulheres com osteoporose, o exame também deve incluir avaliações esqueléticas específicas, como sensibilidade óssea (melhor eliciada sobre a tíbia anterior ou vértebras torácicas), indicando osteomalácia ou doença óssea focal, e frouxidão articular ou esclera azul, características da osteogênese imperfeita.
• Avaliação laboratorial
Para mulheres com osteoporose considerando terapia farmacológica, testes laboratoriais são realizados para avaliar causas secundárias de perda óssea e identificar contraindicações a terapias específicas (Tabela 5).
Os exames de rotina incluem hemograma completo e química sérica geral, especialmente cálcio sérico, creatinina, fosfatase alcalina, albumina e fosfato sérico.
A medição da excreção urinária de cálcio de 24 horas é útil para detectar pacientes com má absorção de cálcio (<100 mg/dia) e aqueles com hipercalciúria (>250 mg/d).
Testes laboratoriais especiais devem ser considerados na presença de exames laboratoriais de rotina anormais, pistas clínicas de outras doenças ou casos incomuns de osteoporose.
• Marcadores bioquímicos de turnover ósseo.
Os marcadores de turnover ósseo são testes séricos que refletem a reabsorção óssea por osteoclastos (telopeptídeo C sérico de jejum do colágeno tipo I) ou a formação óssea por osteoblastos (fosfatase alcalina específica do osso ou propeptídeo N-terminal de procolágeno sérico tipo I).
Os marcadores de turnover ósseo não podem diagnosticar osteoporose e têm capacidade variável de prever risco de fratura em ensaios clínicos.
Os marcadores de turnover ósseo têm sido usados principalmente em ensaios clínicos para demonstrar respostas em grupo ao tratamento.
Embora usado por alguns especialistas em osteoporose, o uso rotineiro de marcadores de turnover ósseo na avaliação de pacientes com osteoporose não é recomendado.
Pontos-chave
• A osteoporose é um distúrbio comum com consequências potencialmente graves.
• A avaliação da saúde esquelética deve fazer parte dos cuidados de rotina para todas as mulheres na pós-menopausa.
• O exame anual deve incluir medidas de altura e peso; avaliação de dor crônica nas costas e cifose; e fatores de risco clínicos para osteoporose, fraturas e quedas.
• Os fatores de risco mais importantes para fraturas futuras são história de fratura prévia, idade avançada e baixa DMO.
– O risco de fratura é especialmente alto nos primeiros 2 anos após uma fratura incidente.
• O teste de densidade mineral óssea é indicado para todas as mulheres na pós-menopausa com fatores de risco para baixa DMO ou fratura.
– DXA é a técnica preferida para testes de DMO.
– Para mulheres na pós-menopausa não tratadas com baixo risco de fratura, o teste repetido de DXA não é útil até que pelo menos 5 anos se passem, a menos que se antecipe uma rápida perda óssea.
• A imagem vertebral é apropriada para mulheres na pós-menopausa com 70 anos ou mais ou com perda histórica de altura.
• Causas secundárias de osteoporose devem ser avaliadas antes do início do tratamento com osteoporose.
• O uso rotineiro de marcadores bioquímicos de turnover ósseo na prática clínica não é recomendado.
TRATAMENTOS NÃO FARMACOLÓGICOS E MODIFICAÇÕES NO ESTILO DE VIDA
Os objetivos do gerenciamento da saúde esquelética em mulheres na pós-menopausa são prevenir ou minimizar a perda óssea e reduzir a probabilidade de fraturas. Todas as mulheres na pós-menopausa, independentemente de sua DMO, fatores de risco clínicos ou risco de fratura, devem ser incentivadas a adotar medidas não farmacológicas e modificações no estilo de vida, como comer uma dieta equilibrada com ingestão adequada de cálcio e vitamina D, ser fisicamente ativo e evitar hábitos de vida prejudiciais, como fumar, para apoiar a saúde geral e óssea.
Essas abordagens gerais, no entanto, não prevenirão a perda óssea na menopausa precoce, não aumentarão significativamente a DMO em mulheres na pós-menopausa e certamente não são tratamento adequado para mulheres com osteoporose.
Para mulheres com alto risco de fratura, a terapia farmacológica para fortalecer o esqueleto é necessária para reduzir o risco de fratura.
Com exceções óbvias, como a Women's Health Initiative (WHI), a maioria dos estudos que avaliam os efeitos de tratamentos não farmacológicos e modificação do estilo de vida é pequena e de curta duração. Como resultado, as recomendações aqui serão baseadas em revisões sistemáticas, metanálises e opinião de especialistas.
• Nutrição
• Cálcio e vitamina D
Ingestões suficientes de cálcio e vitamina D são necessárias para o crescimento esquelético normal durante a infância e adolescência. A importância desses nutrientes em mulheres saudáveis na pós-menopausa é menos clara. Um comitê do Instituto de Medicina (IOM; agora chamado de Academia Nacional de Medicina) concluiu que as evidências científicas apoiam papéis importantes do cálcio e da vitamina D na saúde esquelética. Suas doses diárias propostas de cálcio para mulheres na pós-menopausa foram de 1.000 mg a 1.200 mg, com um limite superior de 2.000 mg (Tabela 6).
A IOM comentou que a recomendação para mulheres de 51 a 70 anos é baseada em dados incertos e inconsistentes.
A ingestão média de cálcio na dieta em mulheres na pós-menopausa nos Estados Unidos e no Canadá é de 700 mg a 800 mg, cerca de um terço dos quais vem de produtos lácteos, o que significa que uma dieta média sem laticínios contém até 500 mg de cálcio. Poucas mulheres saudáveis precisam tomar mais de 50 mg a 600 mg de um suplemento de cálcio para alcançar a ingestão diária recomendada pela OIM. Pacientes com má absorção ou distúrbios do metabolismo do cálcio, como hipoparatireoidismo, podem exigir maiores doses diárias de cálcio e vitamina D. Uma lista do conteúdo de cálcio de alimentos e suplementos está disponível no National Institutes of Health Osteoporosis and Related Bone Diseases National Resource Center.
Não foram observados eventos adversos graves (EAs) com ingestão diária de cálcio inferior a 600 mg.
Ingestões diárias maiores estão associadas a sintomas gastrointestinais, incluindo inchaço e constipação.
No estudo WHI Calcium and Vitamin D, a ingestão média de cálcio na dieta foi de cerca de 1.100 mg por dia. No grupo que tomou 1.000 mg adicionais de um suplemento de cálcio diariamente, o risco de cálculos renais aumentou 17%.
A possibilidade de que um suplemento de cálcio de 1.000 mg por dia (com ingestão diária total de aproximadamente 2.000 mg) esteja associado ao aumento do risco cardiovascular foi aumentada em um ensaio clínico e em uma metanálise subsequente.
Essa associação não foi observada no WHI.
A ingestão diária de cálcio de mais de 1.200 mg não é recomendada para mulheres saudáveis na pós-menopausa ou com osteoporose.
Os benefícios esqueléticos da suplementação de vitamina D em adultos saudáveis são incertos.
A OIM recomenda 600 UI para mulheres com idade entre 50 e 70 anos e 800 UI por dia para aquelas com mais de 70 anos, afirmando que essas ingestões foram suficientes para atingir níveis séricos de 25-OHD de pelo menos 20 ng/mL na maioria das mulheres na pós-menopausa. Metanálises dos efeitos de cálcio e/ou vitamina D no risco de fratura fornecem conclusões inconsistentes, com a maioria relatando nenhum benefício no risco de fratura.
No subestudo de saúde óssea do Ensaio de Vitamina D e Ômega-3, os efeitos da densidade óssea de 2.000 UI de colecalciferol (vitamina D3) diariamente foram avaliados ao longo de 24 meses em mulheres saudáveis (idade média de 63 anos) com níveis séricos basais de 25-OHD de 27,6 ng/mL.
Nenhum efeito foi observado em todo o grupo de estudo ou no subgrupo com níveis séricos basais de 25-OHD inferiores a 30 ng/mL.
A incapacidade de demonstrar eficácia pode estar relacionada ao cálcio e à vitamina D serem nutrientes limiares; deficiências graves podem ser prejudiciais, mas ingestões superiores ao limiar para evitar deficiências não proporcionam benefícios adicionais.
Efeitos salutares da vitamina D com cálcio no risco de fratura foram observados com mais frequência em idosos institucionalizados ou deficientes em vitamina D.
A maioria dos estudos que avaliaram os efeitos do cálcio ou vitamina D não restringiu a população do estudo a participantes deficientes.
A Força-Tarefa de Serviços Preventivos dos EUA (USPSTF) concluiu que não havia evidências suficientes para avaliar o equilíbrio dos benefícios e danos da suplementação diária com vitamina D 400 UI ou mais e cálcio 1.000 mg ou mais por dia para a prevenção primária de fraturas em mulheres na comunidade e na pós-menopausa.
Eles também recomendaram contra o uso de suplementos de vitamina D para prevenir quedas.
Mulheres com osteoporose não precisam de mais cálcio do que mulheres com DMO normal, e não há evidências convincentes de que tomar suplementos de cálcio e vitamina D melhore a eficácia dos medicamentos para osteoporose.
Recomenda-se ingestões adequadas de cálcio e vitamina D ao tomar medicamentos para osteoporose para reduzir o risco de hipocalcemia induzida pelo tratamento.
• Ingestão de proteína
Estudos de relações entre ingestão de proteínas e DMO ou risco de fratura têm sido inconsistentes. Em idosos propensos a quedas que estavam perdendo peso, maior ingestão de proteínas foi associada à redução da frequência de quedas.
• Probióticos
A microbiota intestinal pode influenciar vários aspectos da saúde óssea, incluindo a absorção de cálcio e vitamina D e a resposta imune. Em modelos animais, os probióticos podem prevenir a perda óssea associada à deficiência de estrogênio, e estudos preliminares em humanos sugerem que os probióticos podem ter um papel na prevenção da perda óssea.
• Outros suplementos
O estrôncio é um cátion divalente mais pesado do que o cálcio e aumenta a DMO por ser depositado no esqueleto. O ranelato de estrôncio, um sal de estrôncio proprietário, reduziu o risco de fraturas vertebrais e não vertebrais em mulheres na pós-menopausa com osteoporose.
Este medicamento nunca foi aprovado nos Estados Unidos ou no Canadá e não está mais disponível no resto do mundo devido a preocupações com o aumento do risco cardiovascular.
Outros sais de estrôncio (citrato, cloreto) são promovidos para apoiar a saúde óssea nos Estados Unidos, mas não há evidências de sua eficácia ou segurança.
Metanálise não encontrou relação significativa entre ingestão de magnésio e saúde esquelética.
A suplementação rotineira de magnésio não é recomendada em adultos saudáveis com dietas normais.
Vários suplementos de vitamina K foram promovidos para melhorar a saúde óssea. Uma meta-análise recente não encontrou evidências de que a vitamina K afete a densidade óssea ou o risco de fratura vertebral em mulheres na pós-menopausa e que as evidências foram insuficientes para confirmar uma redução nas fraturas clínicas.
• Fitoestrógenos, incluindo isoflavonas, são compostos derivados de plantas com fraca atividade estrogênica. Em uma revisão sistemática, algumas isoflavonas (forma de aglicona) tiveram um efeito moderadamente benéfico contra a perda óssea com deficiência de estrogênio.
As isoflavonas não são recomendadas como estratégias eficazes para prevenir ou tratar a osteoporose pós-menopausa.
Também não há evidências convincentes de um efeito benéfico de boro, zinco, cohosh preto, berberina ou dehidroepiandrosterona na DMO ou risco de fratura em mulheres na pós-menopausa.
• Evitando fatores nocivos ao estilo de vida
A cessação do tabagismo e a limitação da ingestão de álcool são importantes medidas gerais de saúde. Os EAs do tabagismo na saúde óssea parecem reverter quando o tabagismo é interrompido.
• Atividade física e exercício
A massa esquelética é fortemente influenciada pelo carregamento mecânico. Durante o crescimento em crianças, os programas de exercícios de carga de impacto induzem pequenos ganhos na DMO, enquanto doenças que causam imobilização estão associadas à baixa massa óssea. Uma revisão da Cochrane e várias metanálises encontraram efeitos relativamente pequenos e estatisticamente significativos do exercício na DMO em comparação com os grupos controle em mulheres na pós-menopausa.
A percepção de que o exercício pode reverter a osteoporose em mulheres na pós-menopausa, induzindo nova formação óssea, é infundada.
Programas de exercícios regulares para a saúde geral podem ser recomendados, especialmente aqueles que aumentam a força muscular e melhoram o equilíbrio, levando a menos quedas. Mulheres com osteoporose, especialmente aquelas com fraturas vertebrais, devem evitar atividades que envolvam levantar ou puxar com flexão ou rotação da coluna vertebral para frente e podem se beneficiar de um programa de exercícios para alongar e fortalecer os músculos extensores da coluna vertebral.
• Prevenção de quedas
Pelo menos um terço das mulheres com 65 anos ou mais experimentam uma ou mais quedas a cada ano, e o risco de quedas e de fratura aumenta com o avançar da idade.
Como a maioria das fraturas ocorre como resultado de uma queda, as tentativas de reduzir a incidência de quedas devem ser componentes importantes para reduzir o risco de fraturas em mulheres mais velhas na pós-menopausa.
Um relatório recente do USPSTF e uma revisão da Cochrane descobriram que programas de exercícios multicomponentes, como o tai chi, que visam o equilíbrio, a marcha e a força muscular, foram as maneiras mais eficazes de prevenir quedas e talvez fraturas em idosos.
Afunilando o uso de benzodiazepínicos, agentes neurolépticos e antidepressivos reduziram o risco de queda em mais de 60%.
Protetores de quadril podem ser considerados em pacientes com alto risco de queda, especialmente para pacientes em ambientes supervisionados, como instituições de longa permanência. A iniciativa Stopping Elderly Accidents, Deaths, and Injuries do Centers for Disease Control and Prevention, baseada em diretrizes publicadas, fornece ferramentas úteis para avaliação e gerenciamento de risco de quedas.
Pontos-chave
• Recomendar e promover hábitos saudáveis, incluindo atenção à nutrição, ingestão adequada de cálcio e vitamina D, atividade física e prevenção de hábitos nocivos é apropriado para todas as mulheres na pós-menopausa.
• Nenhuma dessas abordagens pode melhorar significativamente a DMO ou corrigir as anormalidades arquiteturais da osteoporose.
• Os modestos benefícios esqueléticos das medidas não farmacológicas não devem ser interpretados como terapias suficientes ou eficazes para mulheres na pós-menopausa com osteoporose com alto risco de fratura.
• A probabilidade de quedas pode ser diminuída, no entanto, e o risco de fratura pode ser reduzido em mulheres mais velhas. A prevenção de quedas é especialmente importante em mulheres mais velhas ou com mobilidade diminuída.
TERAPIA FARMACOLÓGICA PARA EVITAR PERDA ÓSSEA
Várias drogas com diferentes mecanismos de ação demonstraram a capacidade de prevenir a perda óssea em mulheres na pós-menopausa e reduzir o risco de fratura em mulheres com osteoporose pós-menopausa.
Os mecanismos de ação de todas as drogas para osteoporose são modular (inibir ou ativar) o metabolismo ósseo.
Os agentes antirremodelantes, muitas vezes chamados de drogas antirreabsortivas, incluem estrogênio, agonistas/antagonistas de estrogênio (EAAs), bifosfonatos e denosumabe.
Eles inibem a reabsorção óssea e, em menor grau, a formação óssea. Essas drogas mantêm ou melhoram a DMO e reduzem o risco de fratura, mas não melhoram ou reparam a ruptura da estrutura trabecular.
Em contraste, os agentes osteoanabólicos, estimulando a nova formação óssea, melhoram a estrutura óssea cortical e/ou trabecular e induzem grandes aumentos na DMO, reduzindo as fraturas mais rapidamente do que as drogas antirremodelantes.
• Prevenção versus tratamento
Os medicamentos são aprovados pelas agências reguladoras norte-americanas para prevenir ou tratar osteoporose ou ambos.
Desde 2008, as diretrizes norte-americanas se concentram no uso de drogas para osteoporose para reduzir o risco de fraturas. O conceito de prevenir a osteoporose interrompendo a perda óssea na pós-menopausa e seus danos associados à arquitetura esquelética não é reconhecido nessas diretrizes.
Com base em estudos que demonstram a prevenção da perda óssea em mulheres na pós-menopausa sem osteoporose, várias preparações orais e transdérmicas de estrogênio, isoladamente ou em combinação com progestágenos ou bazedoxifeno (BZA), bem como raloxifeno, tibolona (somente no México) e quatro medicamentos bisfosfonatos (alendronato, risedronato, ibandronato e zoledronato) têm aprovação do governo para prevenção da osteoporose (Tabela 7).
As respostas da densidade óssea a esses agentes ao longo de 2 anos em estudos de prevenção são variadas. Os benefícios da densidade óssea da terapia persistem enquanto a terapia for continuada, mas os efeitos das drogas semelhantes ao estrogênio diminuem quando o tratamento é descontinuado.
Os marcadores de turnover ósseo retornam aos valores pré-tratamento dentro de alguns meses, e a DMO cai para os níveis pré-tratamento dentro de 1 a 2 anos após a interrupção da terapia, efeitos evitados pela mudança para um bifosfonato.
Embora o uso de medicamentos para prevenir a osteoporose não esteja incluído nas diretrizes nacionais de osteoporose, um forte argumento clínico pode ser feito para fazê-lo, especialmente em mulheres que chegam à menopausa com baixa massa óssea.
Em média, as mulheres perdem cerca de uma unidade de escore T (10-12%) de massa óssea em uma transição normal da menopausa.
Esses efeitos são evitáveis com estrogênio e bifosfonatos.
No entanto, com exceção do WHI, faltam fortes evidências de que prevenir a perda óssea em mulheres jovens na pós-menopausa resulta em menos fraturas mais tarde na vida.
Um exercício de modelagem sugeriu que infusões pouco frequentes de zoledronato na menopausa reduziriam substancialmente o risco de fratura e o número de mulheres com mais de 65 anos que tiveram osteoporose.
O apoio ao conceito de prevenção da osteoporose por agentes antirremodelantes também é encontrado no tratamento de mulheres com IAs para câncer de mama não metastático que experimentam perda óssea e aumento do risco de fratura.
Nessas pacientes, bifosfonatos e denosumabe preveniram a perda óssea, e o denosumabe reduziu a incidência de fraturas vertebrais em 50% no primeiro ano de tratamento, inclusive em mulheres com valores normais de DMO no início do estudo.
• Terapia hormonal
Vários produtos de estrogênio sistêmico oral e transdérmico são aprovados pelo governo nos Estados Unidos e no Canadá para prevenção da osteoporose pós-menopausa.
Embora não tenham sido observadas diferenças claras nas respostas da DMO entre diferentes preparações de estrogênio ou entre a administração oral e transdérmica, o estrogênio transdérmico parece ter menos risco de eventos trombóticos venosos e possivelmente acidente vascular cerebral.
• Densidade mineral óssea
Os efeitos benéficos das doses padrão sistêmicas de TH oral ou transdérmica na DMO, incluindo terapia com estrogênio mais progestágeno (EPT) para mulheres com terapia com útero ou terapia isolada com estrogênio (TE) para mulheres sem útero, foram demonstrados em ECRs em mulheres na pós-menopausa mais jovens e mais velhas.
No ensaio Postmenopausal Estrogen/Intervenções de Progestina (N = 875), 0,625 mg de estrogênios conjugados (CE), com ou sem progestágeno (acetato de medroxiprogesterona [MPA] ou progesterona micronizada [MP]), por 3 anos aumentou significativamente a DMO da SL em 3,5% a 5,0%, com um aumento de 1,7% na densidade óssea do quadril.
No WHI, um ECR de 5 anos na pós-menopausa mulheres com idade entre 50 e 79 anos (N = 16.608), doses diárias padrão de EPT (0,625 mg CE mais 2,5 mg de MPA) aumentaram significativamente a densidade óssea de LS e TH em 4,5% e 3,7%, respectivamente, em relação ao placebo.
O estradiol 17-β oral em doses diárias de 0,25 mg, 0,5 em uma metanálise de 57 ECRs em mulheres na pós-menopausa, foram observados aumentos consistentes da DMO com TE ou EPT em todos os locais esqueléticos versus placebo.
Em ensaios de 2 anos de duração, a diferença média na DMO após o EPT foi de 6,8% no LS e 4,1% no NF. Da mesma forma, doses diárias de 0,05 mg e 0,1 mg de acetato de estradiol administradas através de um anel vaginal aumentaram significativamente a DMO do quadril (1,7% e 1,8%, respectivamente) e a DMO LS (2,7% e 3,3%, respectivamente) em comparação com o início.
Doses abaixo do padrão de TE e EPT estão associadas a melhorias significativas, embora menores, na DMO, embora o número de mulheres que experimentam perda óssea em doses mais baixas seja provavelmente maior.
• Risco de fratura
No WHI, o TE com CE isolado e EPT reduziu o risco combinado de fraturas vertebrais, fraturas de quadril e fraturas totais em 34% em comparação com placebo em uma população de fraturas de baixo risco.
O risco de fratura de quadril foi reduzido em 30% (taxa de risco [HR], 0,7; intervalo de confiança de 95% não ajustado [ Metanálise e uma revisão sistemática, dominada pelos resultados do WHI, demonstraram que 5 a 7 anos de TH reduziram significativamente o risco de fraturas de coluna, quadril e não vertebrais.
Como nenhum estudo, incluindo o WHI, avaliou os efeitos do estrogênio no risco de fratura em mulheres com osteoporose, o estrogênio não é aprovado como tratamento para osteoporose pós-menopausa.
Doses de TE ou EPT menores do que as usadas no WHI não foram estudadas em relação à eficácia da fratura.
• Segurança
No WHI, os relatos iniciais de EPT sistêmico mostraram riscos aumentados estatisticamente significativos de câncer de mama, acidente vascular cerebral e eventos tromboembólicos.
Em mulheres com histerectomia prévia, a EC isolada por 6,8 anos resultou em um aumento estatisticamente significativo do risco de acidente vascular cerebral e trombose venosa profunda, enquanto o câncer de mama, doença tendência não significativa para aumento da demência provável em mulheres alocadas para o TE.
Análises de subgrupo sugerem que o momento de início da TH influencia a relação benefício-risco, com efeitos mais favoráveis observados em mulheres com 60 anos ou menos ou dentro de 10 anos da menopausa, incluindo menor risco de doença cardiovascular e possivelmente cognição.
Em mulheres com mais de 60 anos ou mais de 10 anos após a transição da menopausa, o início da TH foi associado a riscos aumentados de acidente vascular cerebral (risco relativo [RR], 1,21; IC 95%, 1,06-1,38) e TEV (RR, 1,96; IC 95%, 1,37-2,80).
• Terapia hormonal descontinuação
Os efeitos benéficos do estrogênio no esqueleto começam a diminuir dentro de alguns meses após a interrupção da terapia. A perda de densidade mineral óssea de 3% a 6% ocorre durante o primeiro ano após a cessação do TE sistêmico ou EPT, e os marcadores de turnover ósseo retornam aos valores pré-tratamento dentro de alguns meses.
Dentro de 2 anos, a DMO cai para níveis observados em mulheres que nunca tomaram estrogênio.
No WHI, a descontinuação do TH foi associada a um retorno do risco de fratura aos níveis observados em mulheres que receberam placebo, sem risco de fratura em excesso observado.
A principal indicação para TH sistêmica é para alívio de sintomas vasomotores (VMS) e outros sintomas da menopausa em mulheres na pós-menopausa com idade inferior a 60 anos e dentro de 10 anos após a menopausa, com benefício secundário na proteção óssea.
No entanto, mulheres bem aconselhadas com sintomas persistentes da menopausa e aquelas com alto risco de fratura em que o uso prolongado de TH é uma opção para mulheres bem aconselhadas que têm baixa massa óssea, independentemente dos sintomas da menopausa, para prevenção de perda óssea adicional e/ou redução do risco de fratura quando terapias alternativas não são apropriadas ou quando se espera que os benefícios do uso prolongado excedam os riscos.
Apesar dos efeitos positivos no osso, iniciar o TH em mulheres com mais de 60 anos ou mais de 10 anos após a menopausa geralmente não é recomendado devido a preocupações com a segurança cardiovascular.
Embora o momento ideal para iniciar o TE ou EPT e a duração ideal da terapia não tenham sido estabelecidos, o TE ou o EPT devem ser amplamente usados nos primeiros anos após a menopausa.
Mulheres com insuficiência ovariana primária, menopausa prematura ou menopausa cirúrgica precoce experimentam EAs de longo prazo no osso, cognição, humor, saúde cardiovascular, saúde sexual e mortalidade.
Para essas mulheres, uma preparação de estrogênio deve ser considerada, a menos que haja contraindicações, para evitar a perda óssea e tratar os sintomas da menopausa, pelo menos até a idade média da menopausa natural.
Doses mais altas de TH podem ser necessárias para fornecer proteção contra a perda óssea em mulheres mais jovens, particularmente aquelas com menos de 40 anos.
• Agonistas/antagonistas receptores de estrogênio
• Raloxifeno
Agonistas/antagonistas de estrogênio, anteriormente conhecidos como moduladores seletivos do receptor de estrogênio, têm propriedades antirreabsortivas semelhantes a estrogênio fracas no osso.
O raloxifeno é o único AAS aprovado para a prevenção e tratamento da osteoporose pós-menopausa.
Em um ECR de 2 anos de 601 mulheres na pós-menopausa sem osteoporose (idade média de 55 anos), o raloxifeno 60 mg por dia melhorou a DMO em 1,6% no LS e 1,2% no NF em comparação com o placebo (diminuições de 0,8% e 1,2%, respectivamente). A perda óssea recomeça quando a terapia com raloxifeno é interrompida.
Os eventos adversos com raloxifeno incluem aumento de ondas de calor, cãibras nas pernas e aumento do risco de TEV.
Em mulheres na pós-menopausa com osteoporose, o raloxifeno reduziu significativamente a incidência de câncer de mama invasivo em 76% após 3 anos e em 59% após 8 anos de terapia.
• Bazedoxifeno com estrogênios conjugados
O bazedoxifeno é um AEA que tem efeitos semelhantes ao raloxifeno na densidade óssea e no risco de fraturas em mulheres com osteoporose.
Não está aprovado como monoterapia nos Estados Unidos ou Canadá.
Uma combinação diária de dose fixa de BZA 20 mg com EC 0,45 mg melhorou a VMS, diminuiu os marcadores de turnover ósseo e preveniu a perda óssea ao longo de 2 anos em mulheres jovens na pós-menopausa.
Em uma análise agrupada de ensaios de fase 3 em mulheres jovens na pós-menopausa com DMO normal ou baixa, as alterações na até 2 anos.
Em ECRs de até 2 anos com a combinação de CE e BZA, a densidade mamográfica das mamas e as taxas de sensibilidade mamária, câncer de mama, sangramento vaginal, eventos cardiovasculares e TEV foram semelhantes ao placebo.
Esta combinação foi aprovada nos Estados Unidos, Canadá e México para o manejo de VMS moderada a grave e nos Estados Unidos e México para prevenção da osteoporose pós-menopausa.
Este produto contém uma advertência semelhante a outros produtos contendo estrogênio.
Os melhores candidatos ao BZA com EC são mulheres na pós-menopausa com útero que precisam de alívio de ondas de calor e prevenção de perda óssea.
Deve-se ter cuidado ao iniciar qualquer TH em mulheres com mais de 60 anos.
• Tibolona
A tibolona, um hormônio sintético derivado do inhame mexicano, tem metabólitos com efeitos estrogênicos, androgênicos e progestogênicos.
Em mulheres jovens na pós-menopausa, a tibolona preveniu ondas de calor, perda óssea e atrofia vaginal.
Em mulheres jovens na pós-menopausa, a tibolona evitou ondas de calor, perda óssea e atrofia vaginal.
Em mulheres com osteoporose pós-menopausa, a tibolona 1,25 mg por dia reduziu significativamente o risco de fratura vertebral e não vertebral, mas aumentou o risco de AVC.
Não foi aprovada nos Estados Unidos ou Canadá, mas é usada no México para a prevenção da osteoporose.
• Bifosfonatos
Esses análogos do pirofosfato se ligam à matriz óssea e são absorvidos pelos osteoclastos em locais de remodelação óssea ativa.
Ao interferir em processos intracelulares importantes, os bifosfonatos prejudicam a função dos osteoclastos.
A remodelação óssea diminui e a DMO aumenta.
Existem bifosfonatos aprovados para a prevenção e tratamento da osteoporose pós-menopausa.
Em mulheres jovens na pós-menopausa, os bifosfonatos aumentam a DMO ao longo de 24 meses em 3,1% a 6,0% no SL e em 1,8% a 4,0% no fêmur proximal.
As doses de zoledronato e alendronato aprovados para prevenção são 50% menores do que as doses aprovadas para o tratamento da osteoporose.
A densidade mineral óssea diminui lentamente ao parar o alendronato ou zoledronato.
Bifosfonatos podem ser considerados para prevenir a perda óssea na menopausa precoce se o estrogênio não puder ser tomado ou quando a terapia com TE ou raloxifeno for descontinuada.
Pontos-chave
• Intervir para evitar a rápida perda óssea e a deterioração da estrutura esquelética é uma oportunidade única de manter a saúde óssea.
• Tal intervenção seria mais apropriada em mulheres com baixa DMO que estão experimentando perda óssea relativamente rápida devido à deficiência aguda de estrogênio nos períodos perimenopausal e pós-menopausa precoce ou na interrupção do TE.
• Para mulheres na pós-menopausa mais jovens e saudáveis, particularmente aquelas com VMS, candidatas à prevenção de perda óssea, o estrogênio sozinho (se não houver útero) ou combinado com progestágeno ou BZA são as terapias mais adequadas.
– Um bifosfonato pode ser escolhido se o estrogênio for contraindicado ou ao parar o TE.
– O raloxifeno é uma boa opção para prevenção da perda óssea em mulheres na pós-menopausa com risco elevado de câncer de mama e VMS pouco frequente.
• Bifosfonatos para prevenir a perda óssea podem ser considerados em mulheres na pós-menopausa com baixa DMO (escore T <-1) e outros fatores de risco para fratura (por exemplo, histórico familiar) que não atendem aos critérios para o tratamento da osteoporose.
FARMACOTERAPIA PARA TRATAR OSTEOPOROSE EM MULHERES NA PÓS-MENOPAUSA
O objetivo principal do tratamento de mulheres com osteoporose é reduzir o risco de fratura.
Todos os medicamentos aprovados para tratamento da osteoporose foram mostrados em ECRs para reduzir o risco de fratura.
Essas drogas variam consideravelmente em seus mecanismos de ação e eficácia. Detalhes e nuances de seu uso são encontrados em revisões citadas. A combinação de terapias geralmente não é recomendada para tratar a osteoporose, embora terapias sequenciais possam desempenhar um papel na prevenção de perdas após certas terapias.
• Drogas antirremodelação
Agentes antirremodelantes inibem a reabsorção óssea por osteoclastos e, secundariamente, a formação óssea.
O tratamento resulta no preenchimento de espaços de remodelação no osso que estão presentes no início da terapia e na abertura de menos novos espaços de remodelação, resultando em aumento da DMO e da força esquelética e diminuição do risco de fratura.
Essas drogas não reparam déficits na arquitetura trabecular.
O denosumabe, o inibidor mais potente da remodelação óssea, reduz a porosidade na cortical óssea.
A proteção contra fraturas ocorre dentro de 1 ano após o início da terapia, persiste enquanto o tratamento for administrado e diminui quando o tratamento é interrompido.
Hipocalcemia foi relatada com alguns desses agentes. Baixo teor de cálcio sérico deve ser corrigido antes de iniciar a terapia.
• Raloxifeno
Em um ECR fundamental de mulheres na pós-menopausa com osteoporose, o raloxifeno reduziu significativamente a incidência de fraturas vertebrais após 3 anos em 30% e 50% em mulheres com e sem fratura vertebral prevalente, respectivamente.
O risco de fratura de quadril e não vertebral não foi reduzido com a terapia com raloxifeno por até 8 anos.
No estudo principal, o uso de raloxifeno foi associado a um aumento significativo de três vezes no risco de TEV sem uma diferença significativa nos eventos coronários ou cerebrovasculares entre o placebo e o raloxifeno.
Em mulheres pós-menopáusicas com fatores de risco para doença cardíaca coronária, sem efeitos significativos do raloxifeno sobre o risco de eventos coronários primários ou acidente vascular cerebral foram observados ao longo de uma mediana de 5,6 anos.
No entanto, o risco de acidente vascular cerebral fatal foi aumentado (HR, 1,49).
• Considerações terapêuticas.
O raloxifeno é uma opção para o tratamento da osteoporose pós-menopausa em mulheres com baixo risco de fratura de quadril, alto risco de câncer de mama e baixo risco de acidente vascular cerebral e TEV.
• Bifosfonatos
Nos ECRs, a terapia oral diária com alendronato, risedronato e ibandronato e a dosagem intravenosa anual com zoledronato reduziram o risco de fraturas vertebrais em 41% a 70% ao longo de 3 anos em mulheres na pós-menopausa com osteoporose.
Alendronato, risedronato e zoledronato também reduziram o risco de fraturas de quadril e não vertebrais em 28% a 50% e 20% a 38%, respectivamente, em estudos de extensão de longo prazo.
Densidade mineral óssea nos platôs HT e FN após cerca de 5 anos, sem mais aumentos nos próximos 4 a 5 anos.
O registro para aprovação governamental dos regimes posológicos semanais e mensais comumente usados dos agentes orais foi baseado em estudos comparando as respostas da DMO à terapia diária e não em estudos de desfecho de fratura (Tabela 8).
Os eventos adversos incluem dor óssea e muscular difusa de mecanismo desconhecido, agravamento dos sintomas gastrointestinais superiores com bifosfonatos orais e sintomas gripais em cerca de um terço dos pacientes com a primeira infusão de zoledronato.
Insuficiência renal ocorreu com zoledronato em pacientes com comprometimento da função renal.
Bifosfonatos orais devem ser usados com cautela, e zoledronato é contraindicado em pacientes com função renal marcadamente comprometida.
A osteonecrose da mandíbula (ONM) ocorre com pouca frequência (1 em 10.000-100.000 pacientes-ano) com doses de osteoporose de bifosfonatos.
Procedimentos odontológicos invasivos e má higiene bucal são fatores de risco para ONM.
A terapia descontinuação antes de um procedimento odontológico invasivo não reduz o risco de ONM, mas melhorar a higiene bucal no pré-operatório e o uso de terapia antimicrobiana tópica com extração dentária parece reduzir o risco.
Um risco dependente da duração de fraturas diafisárias subtrocantéricas ou femorais com características radiológicas atípicas torna-se evidente após 2 a 3 anos de terapia, com uma incidência de cerca de 1 em 1.000 pacientes após 8 a 10 anos de terapia.
O risco dessas fraturas parece ser maior em mulheres asiáticas, em mulheres pós-menopáusicas mais jovens com baixa DMO em vez de osteoporose e em pacientes com algumas doenças esqueléticas genéticas, como hipofosfatasia.
Pacientes em uso de bifosfonatos há mais de 3 anos devem ser advertidos a relatar nova dor na coxa ou virilha para que a avaliação radiográfica possa ser realizada.
O risco de fratura atípica pode diminuir com a descontinuação dos bifosfonatos orais.
• Duração da terapia e feriado de drogas bisfosfonadas.
Os efeitos da terapia com bisfosfonatos na remodelação óssea e na proteção contra fraturas diminuem lentamente (mais de 1-5 anos) quando o tratamento é interrompido.
Devido a essa farmacologia única, uma retirada temporária da terapia (“feriado com bisfosfonatos”) pode ser considerada após 3 a 5 anos de terapia em pacientes com risco de fratura baixo ou moderado e que não atendem mais aos critérios de terapia.
O risco de fratura aumenta novamente quando os pacientes estão fora da terapia oral com bifosfonatos por 2 anos.
O tratamento com osteoporose deve ser reiniciado com um declínio significativo na DMO, fratura intermediária ou outros fatores que alterem o risco clínico.
Para pacientes que permanecem em alto risco após 3 a 5 anos de terapia com bifosfonatos (história de fratura prévia da coluna ou quadril ou múltiplas outras fraturas, valores de DMO do quadril permanecendo na faixa de osteoporose ou que têm outros fatores de risco importantes), continuando com o bifosfonato ou mudando para denosumabe ou um agente osteoanabólico é recomendado.
• Considerações terapêuticas.
Os bifosfonatos são apropriados para reduzir o risco de fratura em mulheres com osteoporose pós-menopausa. Use com cautela em pacientes com insuficiência renal significativa. Considere um feriado de bifosfonatos apenas em mulheres com baixo ou moderado risco de fratura.
• Denosumabe
Este anticorpo monoclonal totalmente humano inibe o ligante RANK, o principal estimulador da reabsorção óssea.
O tratamento com denosumabe 60 mg por injeção subcutânea a cada 6 meses resulta na inibição marcada da remodelação óssea, com a reabsorção inibida mais do que a formação.
Em um ECR principal, a terapia com denosumabe por 3 anos reduziu o risco de fraturas vertebrais em 68% e fraturas de quadril em 40% em mulheres na pós-menopausa com osteoporose.
Em 10 anos, a DMO aumentou 21,7% e 9,2% no LS e HT, respectivamente, e a proteção contra fratura persistiu ou melhorou.
Nesse ensaio, erupção cutânea e infecção cutânea ocorreram com mais frequência com denosumabe do que com placebo, mas não aumentaram em frequência com a terapia de longo prazo.
O denosumabe pode ser usado em pacientes com insuficiência renal, mas a hipocalcemia é mais comum.
Casos raros de fraturas femorais atípicas e ONJ foram observados com terapia de longo prazo.
A relação entre a duração da terapia com denosumabe e esses possíveis EAs não é clara.
Nenhum outro AEs foi observado ao longo de 10 anos de tratamento.
• Descontinuando denosumabe.
Ao interromper o tratamento com denosumabe, os marcadores de turnover ósseo aumentam rapidamente acima dos níveis basais antes de retornar aos níveis pré-tratamento após 1 a 2 anos.
A densidade mineral óssea diminui rapidamente e a proteção contra fraturas vertebrais é perdida.
Foram relatadas fraturas vertebrais, muitas vezes múltiplas, que ocorrem 3 a 18 meses após a interrupção do tratamento com denosumabe.
Não há justificativa para um “feriado” com terapia com denosumabe.
Sempre que o denosumabe é interrompido, a terapia com um bifosfonato deve ser usada para evitar a perda óssea.
• Considerações terapêuticas.
O denosumabe é apropriado para mulheres com osteoporose pós-menopausa, incluindo aquelas com alto risco de fraturas. Não há limite para a duração da terapia com denosumabe. A administração de denosumabe não deve ser adiada ou interrompida além de 7 meses sem terapia subsequente para evitar perda óssea e fraturas vertebrais.
• Calcitonina-salmão
Spray nasal calcitonina-salmão é recomendado para o tratamento da osteoporose apenas para mulheres que não toleram outras terapias.
Calcitonina-salmão pode reduzir a dor e encurtar o tempo de mobilização após uma fratura vertebral aguda.
• Terapias osteoanabólicas
Essas drogas para construção óssea estimulam a formação óssea e restauram a estrutura do osso trabecular, aumentando o número e a largura das trabéculas e melhorando a espessura cortical.
Os efeitos formadores ósseos desses agentes diminuem ao longo de vários meses (terapia antiesclerostina) para alguns anos (agonistas receptores PTH).
Por essas e outras razões, a terapia com agentes anabolizantes é limitada a intervalos de tratamento de 12 a 24 meses.
A densidade mineral óssea é perdida rapidamente quando os agentes osteoanabólicos são descontinuados.
Para manter os benefícios do tratamento, essas terapias devem sempre ser seguidas por um medicamento antirremodelação.
As terapias osteoanabólicas são mais eficazes do que os agentes antirremodelantes no aumento da DMO e na redução de fraturas e devem ser a terapia inicial para osteoporose em mulheres com risco muito alto ou iminente de fratura.
• Agonistas do receptor do hormônio da paratireóide
Teriparatida e abaloparatida ativam o receptor PTH, estimulando a formação óssea nas superfícies ósseas trabecular e endocortical, levando ao aumento da massa e volume esquelético, melhora da microarquitetura trabecular, aumento da largura cortical e aumento da força óssea.
Ambas as drogas, administradas por injeção subcutânea diária, reduzem significativamente os riscos de fratura vertebral e não vertebral.
A eficácia da fratura de quadril não foi demonstrada em ensaios randomizados individuais (limitados pelo tamanho da amostra), mas uma metanálise mostrou eficácia da fratura de quadril com teriparatida.
Hipotensão ortostática com primeiras doses e hipercalcemia são possíveis EAs.
Altas doses de ambas as drogas induziram tumores ósseos em ratos, mas esse risco não foi observado em estudos clínicos.
Nenhum dos medicamentos deve ser usado em pacientes com hipercalcemia, em risco de osteossarcoma ou com metástases esqueléticas.
Anteriormente, o tratamento com ambos os agentes era limitado a 2 anos na vida.
O rótulo da teriparatida mudou (novembro de 2020) para permitir um curso repetido de teriparatida em pacientes apropriados.
Abaloparatida ainda não está disponível no Canadá.
• Teriparatida.
A teriparatida é um peptídeo sintético composto pelos primeiros 34 aminoácidos do PTH.
Em um ensaio principal de fase 3, a terapia com teriparatida por 18 a 19 meses resultou em aumentos da densidade óssea do SL em 9,5% e da densidade óssea do TH em 2,6%.
Os riscos de fratura vertebral e não vertebral foram reduzidos em 65% e 35%, respectivamente. Em mulheres com osteoporose pós-menopausa com alto risco de fratura, a teriparatida reduziu os riscos de fratura vertebral em 56% e as fraturas clínicas em 52% em comparação com o risedronato.
• Abaloparatida.
A abaloparatida é um análogo sintético do análogo peptídico relacionado ao PTH, modificado para potencializar seu efeito anabólico.
Em um ensaio principal de fratura, mulheres com osteoporose pós-menopausa foram randomizadas para abaloparatida cega 80 μg, placebo ou teriparatida aberta por 18 meses.
A densidade mineral óssea aumentou com abaloparatida em 11,2% no SL e em 4,2% após 18 meses na DMO HT. Ao longo de 18 meses, os riscos de fratura vertebral e fratura não vertebral foram reduzidos em 86% e 43%, respectivamente.
Esses benefícios de prevenção de fraturas alcançados com a abaloparatida foram mantidos por mais 2 anos quando as mulheres mudaram para alendronato.
Os aumentos na DMO, especialmente no quadril, foram maiores com abaloparatida do que com teriparatida, mas não houve diferenças significativas no risco de fratura entre as duas terapias.
• Romosozumab
Romosozumab é um anticorpo monoclonal antiesclerostina humanizado que estimula a formação óssea enquanto inibe a reabsorção óssea.
É administrado mensalmente em duas injeções subcutâneas, totalizando 210 mg por 12 meses. Em mulheres com osteoporose pós-menopausa, os aumentos médios da DMO com romosozumabe em 1 ano foram de 13,3% na SL e 6,8% no HT. Com 12 meses de romosozumabe seguidos de 24 meses de alendronato ou denosumabe, os aumentos totais na DMO da SL foram de 14,9% e 18,1%, respectivamente, enquanto os aumentos na DMO do HT foram de 7,0% com alendronato e 9,4% com denosumabe.
Em um ECR fundamental em mulheres com osteoporose pós-menopausa, o romosozumabe, em comparação com o placebo, reduziu significativamente o risco de fratura vertebral em 73% e as fraturas clínicas (>85% das quais não vertebrais) em 36% após 12 meses de terapia.
A redução de 25% no risco de fratura não vertebral não foi estatisticamente significativa.
Em um segundo ensaio principal em mulheres com alto risco de fratura, o romosozumabe foi comparado com o alendronato.
Aos 12 meses, o risco de fratura vertebral foi reduzido em 37% com romosozumabe em comparação com o alendronato.
Após esses 12 meses, todas as mulheres receberam alendronato.
Ao final do estudo (média de 33 meses; 21 mo com alendronato), as fraturas não vertebrais foram significativamente reduzidas em 19% e as fraturas de quadril em 38% em pacientes que receberam romosozumabe durante o primeiro ano do estudo em comparação com aqueles que receberam apenas alendronato por toda parte.
A redução no risco de fratura vertebral observada durante os 12 meses de romosozumabe em comparação com placebo ou alendronato foi mantida por pelo menos 2 anos enquanto as mulheres tomaram denosumabe ou alendronato.
Romosozumab pode produzir reações leves no local da injeção e reações de hipersensibilidade. Em comparação com o alendronato, o romosozumabe foi associado a um risco maior de EAs cardiovasculares maiores (ataque cardíaco, acidente vascular cerebral e morte cardiovascular), mas não houve diferença nas taxas desses eventos com romosozumabe versus placebo. A explicação para a disparidade nos resultados dos dois estudos não está clara.
Romosozumab não é recomendado para mulheres com alto risco de doença cardiovascular, particularmente aquelas que tiveram ataques cardíacos ou derrames recentes.
• Considerações terapêuticas.
A terapia osteoanabólica resulta em ganhos maiores e mais rápidos na DMO e melhor proteção contra fraturas do que os bifosfonatos.
A terapia anabólica deve ser seguida por um potente agente antirremodelante para manter os ganhos na DMO.
Os ganhos de densidade mineral óssea, particularmente no quadril, são maiores quando a droga anabólica é administrada antes da droga antirremodelação em comparação com a sequência oposta.
Os melhores candidatos são mulheres com risco muito alto de fratura, incluindo aquelas com fraturas anteriores e especialmente recentes, DMO muito baixa (escore T abaixo de -3,0) e aquelas que sofrem fraturas ou perdem DMO enquanto tomam terapia antiremodelamento.
DESENVOLVENDO UM PLANO DE TRATAMENTO DE OSTEOPOROSE
A osteoporose é uma doença crônica, progressiva e atualmente incurável que requer manejo ao longo da vida. Não existe um paradigma de tratamento único. Em vez disso, o tratamento deve ser individualizado e depois monitorado e alterado, dependendo do curso do paciente. Diferentes medicamentos são escolhidos dependendo da idade do paciente, DMO, risco de fratura e outras considerações. Além disso, medicamentos diferentes podem ser escolhidos para a mesma paciente em diferentes fases da vida. O manejo ideal implicará o uso de terapias de osteoporose em várias sequências para maximizar os benefícios e minimizar os riscos ao longo da vida útil de uma mulher na pós-menopausa.
A terapia direcionada a metas, ou “tratar-a-alvo”, é um conceito emergente para auxiliar na seleção da terapia inicial ou quando e como mudar a terapia para osteoporose pós-menopausa.
O princípio fundamental desse conceito é que o objetivo do tratamento é alcançar um nível aceitável de risco de fratura ou substituto adequado.
O tratamento inicial é selecionado de acordo com a probabilidade de esse tratamento atingir esse objetivo.
Se a resposta ao tratamento inicial não atingir esse objetivo, uma mudança no tratamento é considerada.
O valor da DMO como um alvo apropriado como substituto do risco de fratura é apoiado por estudos recentes que documentam que o nível de DMO alcançado nos tratamentos de osteoporose se correlaciona fortemente com o risco atual de fratura de uma pessoa; quanto maior a DMO de HT no tratamento, menor o risco de fratura.
Esses estudos sugeriram que o benefício ideal do tratamento é alcançado em valores de escore T de HT entre -2,0 e -1,5. Esses dados são reforçados por evidências robustas de metarregressões de ensaios clínicos publicados de muitos medicamentos, demonstrando uma forte correlação entre a magnitude do aumento da DMO com o tratamento e a redução do risco de fratura vertebral, não vertebral e de quadril.
Esses resultados sugerem que, para pacientes com DMO muito baixa ou risco muito alto de fratura, o início da terapia com um agente osteoanabólico seguido de um medicamento antirremodelante é mais provável de atingir as metas de tratamento da osteoporose.
Os estudos que documentam a superioridade dos tratamentos osteoanabólicos sobre os medicamentos anti-remodelação para reduzir o risco de fratura em pacientes com risco muito alto de fratura apoiam fortemente esta recomendação.
Com base nesses conceitos, a escolha do tratamento inicial é baseada na DMO atual do paciente e no risco de fratura (Tabela 9).
Se a resposta ao tratamento inicial não atingir essa meta, uma mudança no tratamento é considerada. Se o objetivo do tratamento não tiver sido alcançado com a terapia com bisfosfonatos, a mudança para denosumabe ou um medicamento osteoanabólico deve ser considerado.
Se a meta de tratamento for atingida após 3 a 5 anos de terapia com bifosfonatos, a descontinuação do tratamento por um intervalo pode ser considerada, com planos de reiniciar a terapia se ocorrer perda óssea ou fraturas.
Se a terapia com raloxifeno ou denosumabe for interrompida, a mudança para um bifosfonato seria indicada para evitar a rápida diminuição da DMO e a perda da proteção contra fraturas.
A terapia osteoanabólica deve ser sempre seguida por um bifosfonato ou denosumabe.
• Monitorando a terapia com osteoporose
O teste de densidade mineral óssea deve ser repetido 1 a 2 anos após o início da terapia com osteoporose (dependendo do medicamento usado), com muita atenção ao controle de qualidade do teste repetido.
Para pacientes em uso de bifosfonatos, repetir o teste de DMO novamente aos 5 anos é usado para determinar se um “feriado de bifosfonatos” seria considerado
Embora alterações nos marcadores de turnover ósseo sejam usadas por alguns especialistas para avaliar a adesão e a eficácia da terapia, o uso rotineiro de marcadores ósseos não é recomendado.
O contato de acompanhamento por um enfermeiro de consultório pode ser o meio mais eficaz para melhorar a adesão à terapia.
• Pontos-chave
• A escolha do tratamento inicial para osteoporose é baseada na DMO atual do paciente e no risco de fratura.
• O raloxifeno é uma opção para o tratamento da osteoporose pós-menopausa em mulheres com baixo risco de fratura de quadril, alto risco de câncer de mama e baixo risco de acidente vascular cerebral e TEV.
• Os bifosfonatos são apropriados para reduzir o risco de fratura em mulheres com osteoporose pós-menopausa.
– Use com cautela em pacientes com insuficiência renal significativa.
– Considere um feriado de bisfosfonatos apenas em mulheres com baixo risco de fratura que não atendem mais aos critérios de terapia.
• Reinicie a terapia se ocorrer perda óssea ou fraturas ou quando o paciente atender novamente aos critérios de tratamento.
– Para pacientes que permanecem em alto risco de fratura após 3 a 5 anos de terapia com bisfosfonatos, continue o tratamento ou mude para outro medicamento.
• Denosumabe é apropriado para mulheres com osteoporose pós-menopausa, incluindo aquelas com alto risco de fratura.
– Não há limite para a duração da terapia com denosumabe.
– A administração de denosumabe não deve ser adiada ou interrompida além de 7 meses sem terapia subsequente para evitar perda óssea e fraturas vertebrais.
• As terapias osteoanabólicas são mais apropriadamente usadas em mulheres com risco muito alto de fratura, incluindo aquelas com fraturas anteriores e especialmente recentes, DMO muito baixa (escore T abaixo de -3,0) e aquelas que sofrem fraturas ou perdem DMO enquanto tomam terapia antirremodelamento.
– Terapias osteoanabólicas aumentam a massa óssea mais rapidamente e reduzem o risco de fratura de forma mais eficaz do que os bifosfonatos.
– A terapia anabólica deve ser seguida por um agente antirremodelante para manter os ganhos de densidade óssea.
– Os ganhos de densidade mineral óssea, particularmente no quadril, são maiores quando uma droga anabólica é administrada antes de uma droga antirremodelação, em comparação com a sequência oposta.
• A densidade mineral óssea medida durante a terapia se correlaciona com o risco atual de fratura.
• Se a resposta ao tratamento inicial não conseguir evitar a perda óssea ou reduzir o risco de fratura, uma mudança no tratamento deve ser considerada.
• Se ocorrerem EAs relacionados a drogas, estratégias de manejo apropriadas devem ser instituídas.
• Se os EAs persistirem, pode ser necessário mudar para outro agente.
Identificar barreiras à não adesão à terapia e incentivar a adesão ao plano de tratamento.
• Fornecer informações claras às mulheres sobre seu risco de fratura e a finalidade da terapia com osteoporose pode ser uma maneira ideal de melhorar a adesão.
• Dependendo do tratamento, um intervalo apropriado para testes repetidos de DMO é de 1 a 2 anos após o início do tratamento ou quando uma mudança na terapia é considerada.
– O DXA inicial e os exames de acompanhamento devem idealmente ser realizados no mesmo instrumento, usando o mesmo procedimento. A interpretação das alterações na DMO requer atenção cuidadosa ao controle de qualidade da DXA.
• Se ocorrer perda progressiva de DMO ou fraturas durante a terapia, avalie por razões de resposta subótima à terapia, incluindo baixa adesão e condições médicas ou medicamentos subjacentes.
• Mesmo quando o tratamento aumenta os valores de escore T acima de -2,5, o paciente ainda tem o diagnóstico e os riscos de osteoporose.
• O encaminhamento para especialistas em ossos é recomendado para mulheres com escores T muito baixos, resposta inadequada ao tratamento, incluindo declínio progressivo da DMO ou fraturas durante a terapia, ou fatores adicionais (por exemplo, insuficiência renal, hiperparatireoidismo) que exigem tratamento especial.
CONCLUSÕES
• A osteoporose é um problema de saúde crônico e progressivo que afeta uma grande proporção de mulheres na pós-menopausa.
• Os profissionais da menopausa devem estar familiarizados e confortáveis com abordagens para a avaliação e gerenciamento da saúde óssea em seus pacientes.
• Uma vez diagnosticados, pacientes com osteoporose requerem tratamento ao longo da vida.
• O gerenciamento da saúde óssea em mulheres na pós-menopausa envolve a avaliação de fatores de risco para baixa DMO e fratura, incentivando hábitos de vida saudáveis para reduzir fatores de risco e, se indicado, terapia farmacológica.
• Ferramentas eficazes para diagnosticar osteoporose e avaliar o risco de fratura estão disponíveis, e existem estratégias bem estudadas para gerenciar a saúde óssea em mulheres com baixo e alto risco de fratura.
• Individualizando as abordagens de tratamento e monitorando e ajustando essas abordagens se o quadro clínico mudar, as consequências da osteoporose na atividade e no bem-estar de uma mulher na menopausa podem ser minimizadas.
RECOMENDAÇÕES
• Incentivar todas as mulheres na pós-menopausa a empregar práticas de estilo de vida que reduzam o risco de perda óssea e fraturas osteoporóticas: manter um peso saudável, comer uma dieta equilibrada, obter cálcio e vitamina D adequados, participar de atividade física regular, evitar o consumo excessivo de álcool, não fumar e usar medidas para prevenir quedas.
• O exame anual deve incluir medidas de altura e peso, avaliação de dor crônica nas costas, cifose e fatores de risco clínicos para osteoporose, fraturas e quedas.
• Avalie a DMO em todas as mulheres
– Com 65 anos ou mais.
– Com histórico de fratura (exceto crânio, osso facial, tornozelo, dedo e dedo do pé) após a menopausa.
– Com causas médicas de perda óssea, como terapia AE e terapia sistêmica com glicocorticóides de mais de 3 meses.
• Considere o teste de DMO para mulheres na pós-menopausa com menos de 65 anos que tenham um ou mais destes fatores de risco:
– Estrogênio descontinuado com fatores de risco adicionais para fratura.
– Magreza (peso corporal < 57,7 kg] ou IMC < 21 kg/m2)
– História de fratura de quadril em um dos pais.
– Fumar atual.
– Ingestão excessiva de álcool.
– Uso a longo prazo de medicamentos associados à perda óssea, como prednisona ou IA.
• Use DXA como a técnica preferida para o teste de DMO e os menores escores T no LS, TH ou FN para categorização diagnóstica.
• A imagem vertebral é apropriada para mulheres com 70 anos ou mais ou com perda histórica de altura superior a 1,5 pol.
• A OIM recomenda a ingestão diária de cálcio 1.000 mg a 1.200 mg e vitamina D3 400 UI a 800 UI para mulheres com 50 anos ou mais.
• O uso rotineiro de suplementos de cálcio e vitamina D não é recomendado. Suplementos só devem ser usados quando as metas diárias de cálcio e vitamina D não forem alcançadas a partir de fontes dietéticas.
• A terapia medicamentosa é recomendada para prevenir a perda óssea em mulheres na pós-menopausa com
– menopausa prematura, pelo menos até a idade média da menopausa natural.
– Baixa DMO (escore T < -1,0) e experimentando perda óssea relativamente rápida devido à deficiência aguda de estrogênio na transição da menopausa ou na descontinuação do TE.
– Baixa DMO (escore T < -1,0) e outros fatores de risco para fratura (por exemplo, histórico familiar), mas que não atendem aos critérios para o tratamento da osteoporose.
Recomenda-se terapia medicamentosa para tratar osteoporose nessas populações:
– Todas as mulheres na pós-menopausa que tiveram uma fratura vertebral ou de quadril.
– Todas as mulheres na pós-menopausa que têm valores de DMO consistentes com osteoporose (ou seja, escores T < -2,5) na região LS, FN ou HT.
– Todas as mulheres na pós-menopausa que têm escores T de -1,0 a -2,5 e qualquer um dos:
• História de fratura do úmero proximal, pelve ou antebraço distal.
• História de múltiplas fraturas em outros locais (excluindo face, pés e mãos).
• Aumento do risco de fratura de acordo com os limiares específicos do país usando FRAX. Nos Estados Unidos, esses limiares são um risco de 10 anos de fratura osteoporótica maior (coluna, quadril, ombro e punho) de pelo menos 20% ou de fratura de quadril de pelo menos 3%.
• Realize uma avaliação abrangente, incluindo história médica completa, exame físico, avaliação laboratorial e, em mulheres com perda histórica de altura e cifose, imagens vertebrais antes de iniciar a terapia com osteoporose.
• Garantir a ingestão diária total adequada de cálcio (1.000-1.200 mg) e vitamina D (400-800 UI) como terapia adjuvante para todas as mulheres na pós-menopausa que recebem intervenções farmacológicas para osteoporose.
• Considere terapias osteoanabólicas para pacientes com risco muito alto de fratura, incluindo mulheres mais velhas com fraturas recentes, escores T -3,0 e inferiores, ou vários outros fatores de risco.
• Durante a terapia, reavalie as metas do tratamento e a escolha da medicação continuamente por meio de exames médicos periódicos e testes de DMO de acompanhamento.
• Uma vez diagnosticados, as pacientes com osteoporose requerem tratamento ao longo da vida para prevenir fraturas.
Fonte:
“Compartilhar é se importar”
Instagram:@dr.albertodiasfilho
EndoNews: Lifelong Learning
Inciativa premiada no Prêmio Euro - Inovação na Saúde
Postado por
Dr. Frederico Lobo
às
12:15
0
comentários
Enviar por e-mail
Compartilhar no Twitter
Compartilhar no Facebook